
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения задач. Пример 1. Объясните механизм образования молекулы SiF6 и иона [SiF6]2-
|
|
Пример 1. Объясните механизм образования молекулы SiF6 и иона [SiF6]2-
Решение. Приводим электронную формулу атома кремния:
14Si-1s2 2s2 2p6 3s23p2
Подчеркнуты валентные электроны кремния.
Графические схемы распределения электронов по энергетическим ячейкам в:
а) невозбужденном состоянии:
3s 3p 3d
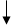
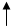


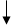
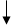






 14Si -…
14Si -…
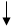

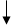

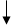

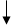





 3s 3p 3d
3s 3p 3d
б) при возбуждении: 14Si* - …
Четыре неспаренных электронов возбужденного атома кремния могут участвовать в образовании четырех ковалентных связей с атомами фтора:
(9F – 1s2 2s2 2p5),
имеющему по одному неспаренному электрону с образованием молекулы.
Для образования иона [SiF6]4- к молекуле SiF4 присоединяются два иона F- (1s2 2s2 2p6), все валентные электроны которых спарены. Связь осуществляется по донорно-акцепторному механизму за счет пары электронов каждого из фторид-ионов и двух валентных 3d-орбиталей атома кремния.
Пример 2. Представьте электронную конфигурацию молекулы О2 по методу МО.
Решение. Представим электронную конфигурацию молекулы О2 по методу МО:
Электронная формула атома кислорода: 8O – 1s22s22p2x2p1y2p1z.
Размещение электронов по молекулярным орбиталям:
2O (1s22s22px22p1y2p1z) =
= O2{(σ св 1s)2(σразр 1s)2(σсв 2s)2(σразр 2s)2 (σ св 2px)2(πcв 2py)2(πcв 2pz)2(πразр2py)1(πразр
2pz)1}
Определим порядок связи: Псв.= (10 – 6) / 2 = 4/2 = 2
В молекуле кислорода две кратные ковалентные химические связи: O = O
Парамагнетизм молекулы кислорода объясняется тем, что на разрыхляющих π - молекулярных орбиталях содержится по одному неспаренному электрону.
Привет 3. В каком из соединений галогеноводородов связь является наиболее полярной?
Решение. Найдем разность относительных электроотрицательностей (ЭО) атомов галогенов и водорода.
| H – F | H – Cl | H – Br | H – I | |
| ЭО | 2,1 - 4,0 | 2,1 - 3,0 | 2,1 - 2,8 | 2,1 - 2,6 |
| ∆ЭО | 1,9 | 0,9 | 0,7 | 0,5 |
Вывод: Связь является наиболее полярной в молекуле HF
Date: 2015-09-25; view: 1414; Нарушение авторских прав