
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения задач. Пример 1.Напишите электронную формулу атома серы
|
|
Пример 1. Напишите электронную формулу атома серы. К какому электронному семейству относится сера? Укажите валентные электроны, распределите их по энергетическим ячейкам в нормальном и возбужденных состояниях.
Решение. У атома серы порядковый номер 16 в таблице Д.И. Менделеева, поэтому – 16 электронов и последовательность заполнения энергетических уровней и подуровней совпадает с электронной формулой (что характерно для элементов с порядковыми номерами от 1 до 20):
16S – 1s2 2s2 2p6 3s2 3p4
Последним заполняется p-подуровень, поэтому сера принадлежит к p-электронному семейству; содержит 6 валентных электронов – 3s2 3p4. Представим схему размещения валентных электронов в квантовых (энергетических) ячейках:







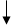


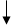 3s 3p 3d
3s 3p 3d
16S -...
 Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS.
Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS.
У атома серы на 3d-подуровне имеются вакантные орбитали. При возбуждении атома происходит разъединение пар электронов и переход их на свободные орбитали.
Представим электронные конфигурации атома серы в возбужденных состояниях:
3s 3р 3d
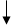

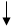







 а) 16S* - …, 16S* - … 3s23p33d1
а) 16S* - …, 16S* - … 3s23p33d1
Валентность серы равна 4, например, в соединениях SO2, H2SO3
3s 3p 3d
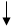

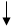

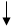

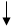

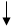


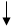


 б) 16S*- … S* - … 3s1 3p3 3d2
б) 16S*- … S* - … 3s1 3p3 3d2
Валентность серы равна 6, например, в соединениях: SO3, H2SO4.
Вывод: валентность серы в соединениях 2, 4, 6.
Пример 2. Составьте электронную формулу атома титана и ионов титана Ti2+ и Ti4+. К какому электронному семейству относится титан? Приведите электронные аналоги титана.
Решение. Порядок заполнения энергетических уровней и подуровней следующий:
22Ti – 1s2 2s2 2p6 3s2 3p6 4s2 3d2
Титан принадлежит к d-электронному семейству.
Электронная формула титана имеет вид:
22Ti – 1s2 2s2 2p6 3s2 3p6 3d2 4s2
Подчеркнуты валентные электроны.
Электронно-графические формулы валентных электронов атома титана в нормальном и возбужденном состояниях:
3d 4s 4p 4d 4f
















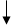
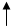

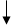
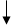



 22 Ti -…
22 Ti -…
Валентность титана в нормальном состоянии равна 2, например, в соединениях: TiO, TiCl2. Такая валентность обусловлена двумя неспаренными электронами, но вакантные орбитали на 4p-подуровне вносят дополнительный вклад в валентность и титан в некоторых соединениях проявляет валентность, равную 3, например, в соединении TiCl3.
При возбуждении атома титана происходит распаривание 4s-электронов и переход их на 4p-подуровень, валентность титана в этом состоянии равна 4 (TiO2, TiCl4):
3d 4s 4p 4d 4f
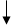
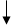




















 22Ti*-…
22Ti*-…
22 Ti* - … 3d2 4s1 4p1 4d0 4f0
Сокращенная электронная формула атома титана:
22 Ti - … 3d2 4s2
Электронные аналоги титана:
40 Zr - … 4d2 5s2; 72 Hf - …5d2 6s2
Электронные формулы ионов титана Ti2+ и Ti4+ соответственно:
22Ti2+ - … 3d2 4s0; 22Ti4+ - … 3d0 4s0.
Пример 3. Для атома с электронной структурой 1s22s22p1 найдите значения четырех квантовых чисел n, l, ml, ms, определяющие каждый из электронов в нормальной состоянии.
Решение. Электронную формулу1s22s22p1 имеет атом бора. Значения квантовых чисел для электронов атома бора надо определять с учетом принципа Паули, согласно которому в атоме не может быть даже двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
1-й энергетический уровень атома бора содержит два электрона в s-состоянии. Эти электроны характеризуются следующим набором квантовых чисел: 1,0, 0, ± ½.
Электроны в s-состоянии второго энергетического уровня имеют значения квантовых чисел: 2,0, 0, ± 1/2.
Электроны в р-состоянии второго энергетического уровня имеют значения квантовых чисел: 2, 1, -1, + 1/2.
Date: 2015-09-25; view: 2724; Нарушение авторских прав