
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Выполнение работы
|
|
Опыт 1. Получение оксида хрома (III) (групповой)
В фарфоровую чашку насыпать горкой небольшое количество дихромата аммония(NH4)2Cr2O7 и горящей спичкой нагреть его сверху. Наблюдать бурное разложение соли. Отметить цвет исходного вещества и продукта реакции. Проверить растворимость последнего в воде.
Требования к результатам опыта:
1. Написать уравнение реакции разложения дихромата аммония и сделать вывод, к какому типу ОВР относится данная реакция.
2. Сделать вывод о растворимости в воде оксида хрома (III)
Опыт 2. Получение и свойства гидроксида хрома (III)
В две пробирки налить по 1-2 мл раствора соли хрома (III) и добавить в каждую по каплям раствор щёлочи до появления серо-зелёного осадка. Для определения свойств Cr(OH)3 добавить в первую пробирку раствор HCl, а во вторую концентрированный раствор щёлочи до полного растворения осадков. (Пробирку с образовавшимся хромитом сохранить для опыта 3).
Требования к результатам опыта:
1. Написать уравнение реакции получения гидроксида хрома (III).
2. Составить уравнения реакций взаимодействия Cr(OH)3 с кислотой и щелочью.
3. Сделать вывод о кислотно-основных свойствах гидроксида хрома (III).
Опыт 3. Восстановительные свойства соединений хрома (III)
В пробирку с хромитом натрия или калия, полученным в опыте 2, добавить пероксид водорода H2O2 до изменения окраски.
Требования к результатам опыта:
1. Закончить уравнение реакции: KCrO2 + H2O2 + KOH =
2. Сделать вывод, какими свойствами – окислительными или восстановительными – обладают соединения хрома (III).
Опыт 4. Взаимные переходы хромата и дихромата
Налить в одну пробирку 2-3 мл раствора хромата калия K2CrO4, а в другую – столько же дихромата калия K2Cr2O7. Заметить окраску в обеих пробирках. В первую пробирку добавить 1-2 мл раствора H2SO4, во вторую 1-2 мл раствора щёлочи. Наблюдать изменения окраски.
Требования к результатам опыта:
1. Написать уравнения реакций перехода хромата в дихромат в кислой среде и дихромата в хромат в щелочной среде.
2. Сделать вывод о влиянии реакции среды на устойчивость хроматов и дихроматов.
Опыт 5. Окислительные свойства соединений хрома (VI)
В две пробирки налить по 1-2 мл раствора K2Cr2O7 и подкислить растворы 1 мл разбавленной H2SO4. Затем в одну пробирку прилить немного свежеприготовленного раствора сульфита натрия, во вторую – раствора нитрита калия. Как изменится окраска растворов?
Требования к результатам опыта:
1. Закончить уравнения реакций: K2Cr2O7 + Na2SO3 + H2SO4 =
K2Cr2O7 + KNO2 + H2SO4 =
2. Сделать вывод, какими свойствами – окислительными или восстановительными – обладают соединения хрома (VI).
Задачи
№ 20.1. Закончить уравнения реакций: а) K2Cr2O7 + KI + H2SO4 =;
б) CrO3 + NaOH =; в) CrCl3 + H2O ↔; г) Cr2O3 + H2SO4 =
№ 20.2. Вычислить тепловой эффект реакции получения хрома по стандартным энтальпиям образования: Cr2O3 + 2Al = Al2O3 + 2Cr
( -1440,6 кДж/моль;
-1440,6 кДж/моль; 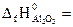 -1676 кДж/моль). (Ответ: -235,4 кДж).
-1676 кДж/моль). (Ответ: -235,4 кДж).
№ 20.3. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Na2Cr2O7 → Na2CrO4 → Na2Cr2O7 → CrCl3
№ 20.4. Закончить уравнения реакций: а) NaCrO2 + PbO2 + NaOH =;
б) K2Cr2O7 + FeSO4 + H2SO4 =; в) Cr2(SO4)3 + H2O ↔
№ 20.5. Какой объем хлора при нормальных условиях выделится при взаимодействии одного моля дихромата натрия с избытком соляной кислоты? (Ответ: 67,2 л).
№ 20.6. Составить уравнения реакций взаимодействия в щелочной среде хлорида хрома (III): а) с бромом (Br2); б) с пероксидом водорода (H2O2).
№ 20.7. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Cr2O3 → Cr2(SO4)3 → Cr(OH)3 → K3[Cr(OH)6]
№ 20.8. Можно ли восстановить хром из его оксида алюминием? Ответ мотивировать, вычислив ΔG0 реакции: Cr2O3 + 2Al = Al2O3 + 2Cr
( -1050 кДж/моль;
-1050 кДж/моль;  -1582 кДж/моль).
-1582 кДж/моль).
№ 20.9. Составить уравнения реакций взаимодействия в щелочной среде сульфата хрома (III): а) с бромом (Br2); б) с диоксидом свинца (PbO2).
№ 20.10. Учитывая, что координационное число хрома (III) равно 6, написать уравнения реакций образования комплексных соединений хрома и назвать их: а) CrCl3 + KCN (избыток) =;
б) Cr(OH)3 + NaOH (избыток) =; в) CrCl3 + NH4OH (избыток) =
№ 20.11. Написать в молекулярном и ионном виде уравнения реакций гидролиза солей хрома: а) CrCl3 + Na2S + H2O =;
б) Cr2(SO4)3 + K2CO3 + H2O =; в) Cr(NO3)3 + H2O ↔
№ 20.12. Вычислить молярную массу эквивалентов и эквивалент восстановителя в реакции: 2СrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl + 8H2O
№ 20.13. При сплавлении хромита железа Fe(CrO2)2 с карбонатом натрия в присутствии кислорода хром (III) и железо (II) окисляются и приобретают степени окисления +6 и +3. Составить уравнение реакции.
№ 20.14. Можно ли получить хром восстановлением Cr2O3 водородом с образованием водяного пара при стандартном состоянии всех веществ? Ответ обосновать, рассчитав ΔG0 реакции: Cr2O3 + 3Н2 = 3Н2O (г) + 2Cr.
( -1050 кДж/моль;
-1050 кДж/моль; 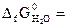 -228,6 кДж/моль).
-228,6 кДж/моль).
№ 20.15. Закончить уравнения реакций: а) Na2CrO4 + H2SO4 =;
б) Na2Cr2O7 + NaOH =; в) Na2Cr2O7 + HCl =; г) Cr + HCl =
№ 20.16. Закончить уравнения реакций окисления соединений хрома (III):
а) Cr2O3 + NaNO3 + Na2CO3  ; б) Cr(NO3)3 + NaBiO3+ HNO3 =;
; б) Cr(NO3)3 + NaBiO3+ HNO3 =;
№ 20.17. Вычислить молярную массу эквивалентов и эквивалент окислителя в реакции: Al + K2Cr2O7 + H2SO4 =
№ 20.18. Закончить уравнения реакций:
а) Cr2O3 + H2SO4 =; б) Cr2O3 + КОН 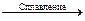 ; в) Cr2O3 + КОН + KMnO4 =
; в) Cr2O3 + КОН + KMnO4 =
№ 20.19. Предложить 4 способа получения Cr2O3. Составить соответствующие уравнения реакций.
№ 20.20. Сколько требуется дихромата калия для приготовления 2 л 0,1 н (по отношению к реакциям окисления в кислой среде) раствора K2Cr2O7?
(Ответ: 9,8 г).
Date: 2015-09-24; view: 697; Нарушение авторских прав