
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тема: Введение в биоорганическую химию. Строение органических соединений, взаимное влияние атомов в молекулах. Кислотно-основные свойства
|
|
- Введение в биоорганическую химию
- Электронное строение органических соединений
- Кислотные и основные свойства веществ
Биоорганическая химия изучает строение, химико-физические свойства и биологическое действие органических веществ, участвующих в процессе жизнедеятельности.
Отдельно, как наука, биоорганическая химия выделилась в начале ХХ века. Объектом её изучения стали биополимеры и биорегуляторы.
Биополимеры – сложные вещества, играющие основную роль в жизнедеятельности организма.
Примеры:
- Белки –
- Полисахариды –
- Липиды в составе биорегуляторов –
- Нуклеиновые кислоты –
Биорегуляторы – вещества, регулирующие жизнедеятельность организма.
- Витамины –
- Гормоны –
- Синтетические медикаменты –
Биоорганическая химия полезна тем, что её механизмы основополагающи для многих других наук – биохимии и биофизики, в частности. Поняв работу и взаимодействие биоорганических соединений, можно легко понять и их предназначение для организма.
Электронное строение органических соединений.
Атомная орбиталь – это область наиболее вероятного местонахождения электрона в электрическом поле ядра атома. Существуют разные типы орбиталей – s-,p-,d- и f- орбитали. Они различаются по своей форме и количеству энергии, удерживающей электроны.
В соответствии с количеством электронов вокруг атома, элементы располагаются по таблице Менделеева. Важнейшие из элементов-органогенов находятся в первом, втором и третьем периодах.
Гибридизация атомных орбиталей
Гибридизация атомных орбиталей – это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей с одинаковыми формами и энергией.
Различают основное и возбуждённое состояние атомной оболочки. В возбуждённом состоянии электроны переходят на пустые ячейки незаполненных орбиталей более высокого уровня при наличии таковых.
Типы гибридизации
- sp3-гибридизация – образование у атома углерода четырёх sp3-орбиталей из одной s- и трёх p-орбиталей. Характерны для насыщенных соединений. Такая гибридизация имеет форму тетраэдра
- sp2-гибридизация – образование трёх sp2-орбиталей из одной s- и двух p- орбиталей. Третья p-орбиталь не гибридизуется. Характерны для соединений с двойными связями.
- sp-гибридизация – гибридизация одной s- и одной p- орбиталей. Две оставшиеся p-орбитали не гибридизуются. Молекула линейна. Характерна для молекул с тройной связью.
Химические связи для атома углерода
Химические связи органических молекул в большинстве своём ковалентные.
Ковалентная химическая связь – это связь, при которой два атома соединяются за счёт общей электронной пары.
Существует два типа связи между атомами углерода в органической химии:
- σ-связь – перекрывание гибридных орбиталей по осевой линии. Σ-связь одинарна и образуется только за счёт гибридных орбиталей.
- π-свзяь. Свзяь, образованная за счёт бокового перекрывания негибридизованных орбиталей с максимумом перекрывания по обе стороны по прямой, соединяющей ядра атомов. Π-связь входит в составы двойных и тройных связей.
Сопряжение и ароматичность
Ковалентная связь в органических соединениях может быть двух типов:
- Локализованная связь – связь, электронная пара которой находится в поле двух ядер и связывает только два атома.
- Делокализованная связь – связь, молекулярная орбиталь которой охватывает больше двух атомов.
Делокализованные связи – это только π-связи. Они связаны с сопряжёнными системами.
Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате бокового перекрывания негибридных π-орбиталей.
Сопряжение бывает двух типов:
- π-π-сопряжение наблюдается в системах, содержащие чередующиеся кратные связи (двойная-одинарная-двойная)
- π-p-сопряжение характерно для систем, содержащих чередующиеся кратные связи и гетероатомы с неподелённой электронной парой на p-орбитали (двойной – одинарный – гетероатом)
Системы с открытой цепью сопряжения
Системы с открытой цепью сопряжения обычно содержат в себе структурный фрагмент (гетероатом) с неподелённой электронной парой (p-электроны гетероатома сопрягаются со свободными электронами). Гетероатом в таких системах должен отделяться от кратной связи только одной σ-связью. Неподелённая электронная пара гетероатома участвует в p-π-сопряжениях.
Сопряжённые системы с закрытой цепью сопряжения
Лучше всего рассматривать ароматичность соединений на примере бензола – наиболее ароматичного из всех соединений. Молекула бензола – правильный шестиугольный цикл с шестью атомами углерода, равными углами и связями. В нём каждый электрон делокализован, за счёт чего образуется замкнутая цепная связь. У бензола шесть атомных орбиталей, которые в равной степени перекрываются, в результате чего образуется единая делокализованная π-система на основе π-π-сопряжения, которое выравнивает все связи в молекулы на гибридные.
Критерии ароматичности соединения:
- Плоский цикл
- Все атомы цикла в sp2-гибридном состоянии
- Из электронов соединения образуется единая π-электронная система.
- Выполняется правило Хюккеля – 4n+2= е, где n – любое число, а e – количество электронов в системе.
Правило Хюккеля – система ароматична, если она плоская,замкнутая и содержит
4n+2 делокализованных электронов.
Для ароматических систем характерны следующие свойства:
- Высокая термодинамическая стабильность
- Способность вступать в реакции замещения, а не присоединения
- Устойчивость к действию окислителей и температуры
Ароматические гетероциклы
Электронное строение пиррольного атома азота:

- Неподелённая электронная пара находится на негибридной p-орбитали
- Неподелённая электронная пара участвует в p-π сопряжении.
- Система переизбыточна, так как атом азота отдаёт π-электроны в систему
- Пиррол проявляет кислотные свойства
Электронное строение пиримидинового атома азота:

- Неподелённая электронная пара находится на гибридной sp3-орбитали
- неподелённая электронная пара не участвует в сопряжении
- Система недостаточна, так как неподелённая пара находится за пределами системы
- Пиримидин проявляет основные свойства
Сопряжение приводит к выравниванию длин связей, энергетической стабилизации молекул (чем длиннее связь, тем больше термодинамическая устойчивость) (тут вопрос: разве не наоборот?).
Сопряжённые системы содержат меньший запас внутренней энергии и, в основном, занимают более низкий энергетический уровень, чем несопряжённые системы.
Электронные эффекты
Электронные эффекты передаются в молекуле двумя путями:
- индуктивным (индукционным) эффектом
- мезомерным эффектом
Индуктивный эффект (I-эффект) – смещение электронной плотности по цепи σ-связей за счёт влияния заместителей.
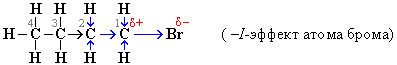
Индуктивный эффект обозначается стрелками.
Индуктивный эффект направлен в сторону атома с наибольшей электроотрицательностью. В результате смещения электронной плотности на всех смежных атомах возникают дробные заряды (δ-минус на броме и δ-плюс на углеродах)
Индуктивный эффект является затухающим – чем дальше от заместителя, тем он меньше.
Положительный индуктивный эффект проявляют электронодоноры, которые притягивают электроны слабее, чем атом водорода (углерода?)
Отрицательный I-эффект проявляют заместители, которые притягивают электроны сильнее, чем атом водорода (углерода?) – электроноакцепторы (галогены, кислород и т.д.)
Индуктивный эффект записывается с обозначением заместителя, рождающего этот эффект и его знаком.
Мезомерный эффект – смещение электронной плотности по сопряжённой системе π-связей за счёт влияния заместителя.
М-эффект не затухает, в отличие от индуктивного.
Положительный М-эффект проявляют заместители, содержащие гетероатом с неподелённой электронной парой на p-орбитали. (тиолы, ОН, аминогруппа)
Отрицательный М-эффект прояляют заместители, в составе которых есть гетероатом, не содержащий неподелённых электронных пар на p-орбитали
Мезомерный эффект показывают изогнутыми стрелками с направлениями по π-связи. Конечный эффект заряда проявляется на крайних атомах – заместителе и дальнейшем от него.
| <== предыдущая | | | следующая ==> |
| Предприятие и связанные с ним общественные группы | | | Спорт та мир |
Date: 2015-09-24; view: 765; Нарушение авторских прав