
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Задача 893
|
|
Какие из перечисленных ниже солей подвергаются гидролизу: NH4I, Na2S, Al(CH3COO)3, CaCl2?
Решение:
Иодид аммония - соль, образованная сильной кислотой и слабым основанием. Гидролиз соли: гидролизу подвергается катион соли. Реакция раствора кислая: рН<7.
NH4I + HOH «NH4OH + HI.
Или в ионном виде:
NH4+ + HOH «NH4OH + H+.
Сульфид натрия – соль, образованная сильным основанием и слабой кислотой.
При растворении солей многоосновных кислот гидролиз протекает ступенчато:
Na2S + H2O «NaHS + NaOH.
Или в ионной форме:
S2– + H2O «HS– + OH–.
Гидролизу подвергается анион соли. Процесс отражает гидролиз по первой стадии.
Чтобы гидролиз соли многоосновной кислоты прошел полностью, как правило, увеличивают температуру процесса:
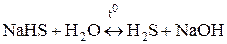 ,
,
или в ионной форме: 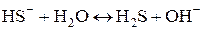 .
.
Раствор такой соли проявляет щелочную реакцию рН>7.
Ацетат алюминия – соль, образованная слабым основанием и слабой кислотой. Гидролизу подвергается как катион, так и анион соли:
Al(CH3COO)3 + H2O «AlOH(CH3COO)2 + CH3COOH.
Параллельно идут два процесса:
Al3+ + H2O «AlOH2+ + H+,
CH3COO– + H2O «CH3COOH + OH–.
В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих соль. Для гидролиза А1(СН3С00)3 реакция полученного раствора будет слабокислотной, поскольку константа диссоциации А1(OН)3 (К=1,38×10-9) меньше константы диссоциации уксусной кислоты (К=I,75×10-5).
Хлорид кальция - соль, образованная сильным основанием и сильной кислотой. Взаимодействие с водой можно представить таким образом:
CaCl2 + 2H2O «Ca(OH)2 + 2HCl,
H2O «H+ + OH–.
Однако единственным малодиссоциирующим соединением в реакции остается сама вода, следовательно, равновесие реакции полностью смещено влево - гидролиз не идет. Раствор соли проявляет нейтральную среду.
Реакция гидролиза представляет собой эндотермический процесс. Поскольку гидролиз является обычным равновесным процессом, то он зависит от всех тех факторов, которые влияют на равновесие реакций, и к нему применимо правило Ле-Шателье.
Date: 2015-09-24; view: 587; Нарушение авторских прав