
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основні хімічні поняття
|
|
Атом – найменша хімічно неподільна електронейтральна частинка матерії, що складається з позитивно зарядженого ядра й негативно заряджених електронів і є носієм хімічних властивостей елемента.
Молекула – найменша частинка речовини, яка має сталий склад і зберігає її хімічні властивості.
Атомна (молекулярна) маса Ar (Mr) – значення маси атома (молекули), виражене в атомних одиницях маси. 1 атомна одиниця маси /а.о.м./ дорівнює 1/12 частини маси атома ізотопу Карбону 12С і становить 1,66 · 10–24 г.
Молекулярна маса конкретної речовини дорівнює сумі мас атомів усіх елементів, що входять до складу молекули.
Елемент – тип атомів, що мають однакові хімічні властивості, однакове протонне число й певне середнє значення атомної маси.
Валентність – здатність атома утворювати хімічний зв'язок. За одиницю валентності приймають один хімічний зв'язок, що здатний утворити атом Гідрогену.
Ступінь окиснення – умовний заряд, що має елемент в йонній сполуці чи мав би в ковалентній сполуці, якби загальна електронна пара була б цілком зміщена до більш електронегативного елемента.
Моль – кількість речовини, що містить 6,02 · 1023 структурних одиниць (атомів, молекул, йонів, електронів і т. ін.). Маса 1 моль даної речовини називається її молярною масою. Вона вимірюється в г/моль і позначається буквою «М». Молярну масу знаходять, як відношення маси речовини до її кількості:
M =  , г/моль.
, г/моль.
Наприклад, молярна маса сульфатної кислоти М(Н2SO4) = 98 г/моль.
Еквівалент (Е) – масова кількість речовини, що взаємодіє з одним атомом чи йоном Гідрогену чи заміщає таку його кількість у хімічних реакціях. Еквівалент може дорівнювати (або бути меншим) відповідній формульній одиниці речовини, що бере участь у конкретній реакції. Число, що вказує на частину формульної одиниці речовини, еквівалентну одному йону Гідрогену (або одному електрону) в певній реакції, називають фактором еквівалентності. Еквівалент речовини залежить від того, в якій конкретно реакції бере участь ця речовина.
Масу 1 моль еквівалентів речовини називають молярною масою еквівалентів речовини (МЕ).
Молярні маси еквівалентів простих речовин розраховують за формулою:
МЕ = 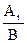 , (г/моль).
, (г/моль).
Наприклад: МЕ(Н2) = 1 г/моль, МЕ(О2) = 8 г/моль.
Date: 2015-09-24; view: 451; Нарушение авторских прав