
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

По водороду
|
|
Цель работы: практически, опытным путем научиться определять эквивалент и эквивалентную массу металла по объему газа, выделенного в ходе реакции. Научиться проводить различные рациональные расчеты с использованием закона эквивалентов.
Теоретическая часть
Из закона постоянства состава, кратных и объемных отношений следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях, которые называют эквивалентами или эквивалентными массами. Для определения эквивалентов и эквивалентных масс нужно знать, что такое моль и мольная масса.
Моль ─ это количество вещества, в котором содержится число частиц любого определяемого сорта, равное постоянной Авогадро (6,02·1023). Например: 3·1024 молекул воды составят 5 моль.
Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.). Масса 1 моля вещества выражается в г/моль. Например: молярная масса Н2О и атомная масса кислорода соответственно равны 18 и 16 а.е.м., их мольные массы равны 18 г/моль и 16 г/моль.
Эквивалентом элемента называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях НВr, Н2О, РН3 эквиваленты брома, кислорода, фосфора соответственно равны 1 моль, 1/2 моль, 1/3 моль.
Масса одного эквивалента называется его эквивалентной массой. Так, в приведенных выше примерах эквивалентные массы брома, кислорода, фосфора соответственно равны 79,9 г/моль, 16:2 = 8 г/моль, 31:3= 10,3 г/моль.
Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества. Расчеты, связанные с определением эквивалентных масс, проводятся по закону эквивалентов: массы (объемы) реагирующих друг с другом веществ пропорциональны их эквивалентным массам (объемам). Математически закон выражается зависимостью:
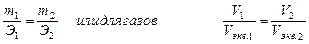 , (1)
, (1)
где m (V) ─ массы (объемы) реагирующих веществ;
Э (Vэкв.) ─ эквивалентные массы (объемы).
Эквивалентную массу простого вещества можно вычислить по формуле:
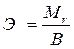 ,
,
где 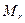 ─ мольная масса атома элемента,
─ мольная масса атома элемента,
В ─ валентность элемента.
Так например, эквивалентные массы водорода и кислорода соответственно равны:

Эквивалентный объем газа можно вычислить по формуле:
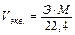 .
.
Так например, эквивалентные объемы водорода и кислорода соответственно равны:
 .
.
Эквивалентные массы сложных веществ можно вычислить по формулам:
 (2)
(2)
где nO, nOH, nH, nMe – число атомов кислорода, гидроксильных групп, атомов водорода, металла соответственно в оксиде, основании, кислоте, соли;
В – валентность;
8 – эквивалентная масса кислорода;
1 – эквивалентная масса водорода;
17 – эквивалентная масса гидроксильной группы.
В данной работе определение эквивалентной массы металла основано на измерении объема водорода, вытесненного активным металлом из разбавленной кислоты. Измеренный объем водорода при условиях опыта приводится к нормальным условиям:
 (3)
(3)
затем по формуле (1) определяют эквивалентную массу.
Прибор для определения эквивалента металла состоит из бюретки 1, соединенной резиновыми трубками, снабженными зажимом 4, с воронкой 2 и двухколенной пробиркой 3. Прибор смонтирован на штативе Бунзена.

Рис.1.1. Прибор для определения эквивалента металла
Практическая часть
Date: 2015-09-24; view: 637; Нарушение авторских прав