
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Раздел 6. Управление химическими реакциями, закон действующих масс
|
|
Задание 8 (по вариантам)
1. В каком направлении сместится равновесие обратимой реакции: 2 SO2 (г) + O2 (г) = 2 SO3 (г), ΔН° = –46 кДж/моль а) при повышении давления;
б) при понижении температуры.
2. Как изменится скорость реакции при уменьшении давления в 2 раза?
а) Н2 (г) + Cl2 (г) = 2 НCl (г).
б) 2Al (к) + 3Cl2 (г) = 2 AlCl3 (r)?
3. В каком направлении сместится равновесие реакции: СО2 (г) + С (к) =
= 2 СО (г), ΔН° = 86 кДж/моль а) при понижении давления; б) при повышении температуры.
4. Написать выражение для скорости прямой реакции: N2 (г) + О2 (г) = 2 NО (г). Как изменится скорость прямой реакции при увеличении концентрации азота и кислорода в 3 раза?
5. В каком направлении сместится равновесие реакции: N2 (г) + 3 Н2 (г) = 2 NН3 (г), ΔН° = –46 кДж/моль а) при повышении давления; б) при повышении температуры?
6. Реакция протекает по уравнению: N2 (г) + 3Н2 (г) = 2 NН3 (г). Как изменится скорость реакции, если концентрацию N2 увеличить в 3 раза, а концентрацию Н2 увеличить в 2 раза?
7. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 32 раза, принимая температурный коэффициент скорости реакции равным двум?
8. В каком направлении сместится равновесие реакции: 2 NО (г) + О2 (г) = 2 NО2 (г)?
а) при увеличении концентрации NО;
б) при уменьшении концентрации О2;
в) при уменьшении концентрации NО2.
9. Определить температурный коэффициент скорости реакции, если при понижении температуры на 50°С реакция замедлилась в 32 раза.
10. Как изменится скорость реакции, протекающей по уравнению: N2 (г) +
+ О2 (г) = 2 NО (г), если реакционную смесь вдвое обогатить кислородом при постоянном давлении?
11. Написать выражение для скорости прямой реакции: N2 (г) + О2 (г) = 2 NО (г). Как изменится скорость прямой реакции при увеличении температуры на 30°С, если температурный коэффициент скорости реакции равен двум?
12. В каком направлении сместится равновесие реакции: РCl3 (г) + Cl2 (г) = =РCl5 (г), ΔН° = –63 кДж/моль а) при понижении давления; б) при понижении температуры.
13. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 32 раза, если температурный коэффициент Вант-Гоффа принять равным двум?
14. Реакция протекает по уравнению А (г) + 2 В (г) = АВ2 (г). Определите, во сколько раз изменится скорость реакции если: а) уменьшить концентрацию вещества А в 2 раза; б) увеличить концентрацию вещества В в 3 раза.
15. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 32 раза, принимая тем-пературный коэффициент равным 2?
16. Во сколько раз увеличится скорость прямой реакции А + 2В = С, если концентрацию вещества А увеличить в 3 раза?
17. В каком направлении сместится равновесие экзотермической реакции
N2(г) +3 Н2(г) = 2NН3(г) при повышении давления?
18. В каком направлении сместится равновесие экзотермической реакции
N2(г) +3 Н2(г) = 2NН3(г) при повышении температуры?
19. Во сколько раз уменьшится скорость прямой реакции А + В = 2С, если концентрацию вещества А уменьшить в 3 раза?
20. В каком направлении сместится равновесие эндотермической реакции 2NO(г) + О2(г) = 2NО2(г) при понижении давления?
21. Во сколько раз уменьшится скорость прямой реакции А + В = 2С, если концентрации веществ А и В уменьшить в 2 раза?
22. В каком направлении сместится равновесие эндотермической реакции 2NO(г) + О2(г) = 2NО2(г) при повышении температуры?
23. Равновесные концентрации веществ в обратимой реакции 2 SO2 + O2 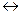 2 SO3 составляют (моль/л): [SO2] = 0,0002; [O2] = 0,004; [SO3] = 0,003. Вычислить константу равновесия.
2 SO3 составляют (моль/л): [SO2] = 0,0002; [O2] = 0,004; [SO3] = 0,003. Вычислить константу равновесия.
24. Рассчитать, как изменится скорости прямой реакции при увеличении давления вдвое в системах: H2 + J2 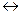 2 HJ и 2 NO + O2
2 HJ и 2 NO + O2 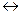 2 NO2, в какую сторону сместится равновесие?
2 NO2, в какую сторону сместится равновесие?
25. Реакция между оксидом азота и хлором протекает по уравнению 2 NO + +Cl2 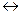 2 NOCl. Как изменится скорость реакции при увеличении:
2 NOCl. Как изменится скорость реакции при увеличении:
а) концентрации оксида азота в два раза;
б) концентрации хлора в два раза.
в) концентрации обоих веществ в два раза?
26. Как отразится повышение давления на равновесие в системах: а) 2 Н2 (г) + +О2 (г) 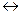 2 Н2О (ж); б) СО2 (г) + С (тв)
2 Н2О (ж); б) СО2 (г) + С (тв) 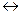 2 СО (г); в) СаСО3 (тв)
2 СО (г); в) СаСО3 (тв) 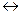 СаО (тв) + СО2 (г)?
СаО (тв) + СО2 (г)?
27. Реакция горения этана выражается термохимическим уравнением: С2Н6 (г) +31/2 O2=2CO2 (г) +ЗН2О (ж); ΔH х.р= —1559,87 кДж. Вычислите теплоту образования этана, если известны теплоты образования СО2 (г) и Н2О(ж).
28. Быстрее будет протекать реакция при комнатной температуре цинка с соля-ной кислотой концентрации 10% или 30%, почему?
29. Быстрее будет протекать реакция при комнатной температуре железа с соляной кислотой концентрации 5% или 15 %, почему?
30. Как повлияет увеличение давления на смещение обратимой реакции
2СО + О2 ↔ 2СО2
31. В каком направлении сместится равновесие экзотермической реакции
N2 (г) +3 H2 (г) = 2NH3 (г) при повышении температуры?
32. При температуре 334 К реакция заканчивается за 18 мин. За какое время эта реакция заканчивается при 374 К, если температурный коэффициент равен двум?
33. При температуре 304 К реакция заканчивается за 18 мин. За какое время эта реакция заканчивается при 274 К, если температурный коэффициент равен двум?
34. При температуре 265 К реакция заканчивается за 10 мин. За какое время эта реакция заканчивается при 245 К, если температурный коэффициент равен двум?
35. При температуре 265 К реакция заканчивается за 16 мин. За какое время эта реакция заканчивается при 275 К, если температурный коэффициент равен двум?
Date: 2015-09-22; view: 840; Нарушение авторских прав