
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Биотехнологические основы культивирования микроорганизмов. 1 page
|
|
Обобщенная схема промышленного выращивания микроорганизмов с целью получения конечных продуктов представлена на рис 9.
Исходная культура (5-10 мл)
↓
Встряхиваемая колба (200-1000 мл)
↓
Ферментер для посевного материала (10-100 л)
↓
Промышленный ферментер (>100 л)
↓
Сбор биомассы
↓
Клетки (Культуральная среда)
↓
Разрушение (экстракция)
↓
Очистка продукта
Рис. 9. Схема промышленного выращивания микроорганизмов.
Переход от лабораторного синтеза к промышленному – это не просто увеличение масштаба, т.е. условия, оптимальные для малых объемов не будут оптимальными для больших. Например, аэробные микроорганизмы хорошо растут в обычной колбе на 200 мл при аэрации ее содержимого с помощью мешалки мощностью 300 Вт. Если просто увеличить объем «колбы» до 10000 литров, то потребуется мешалка мощностью 15 МВт. Ее мотор будет размером с дом, а при перемешивании выделится столько тепла, что микроорганизмы погибнут. Поэтому для получения максимального выхода как в малых (от 1 до 10 л), так и в больших (>1000 л) биореакторах необходимо оптимизировать множество параметров: температуру, рН, способ и интенсивность перемешивания и (в случае аэробных организмов) – концентрацию кислорода. Считают, что оптимальные условия изменяются при каждом десятикратном увеличении объема биореактора. Промышленное выращивание микроорганизмов с целью получения очищенного продукта – ферментация – процесс многоступенчатый (рис. 9). Обычно процедура начинается с приготовления и стерилизации культуральной среды и оборудования. Сначала выращивают исходную культуру (5-10 мл), затем инкубируют ее во встряхиваемой колбе (200-1000 мл), после чего переносят в ферментер для посевного материала (10-100 л) и, наконец, в промышленный ферментер (1000-1000000 л). По завершении ферментации клетки выделяют из культуральной среды центрифугированием или фильтрацией. Если продукт локализован внутри клеток, последние разрушают, удаляют клеточные осколки и выделяют продукт из осветленной среды. Секретируемый продукт выделяют непосредственно из среды.
Рост и развитие микроорганизмов. В последние 15 лет для выращивания продуцентов ферментов чаще используют глубинный метод культивирования (рис. 10). В промышленных условиях для этих целей применяют ферментеры из нержавеющей стали, снабженные приспособлениями для перемешивания и подачи в жидкую питательную среду стерильного воздуха.
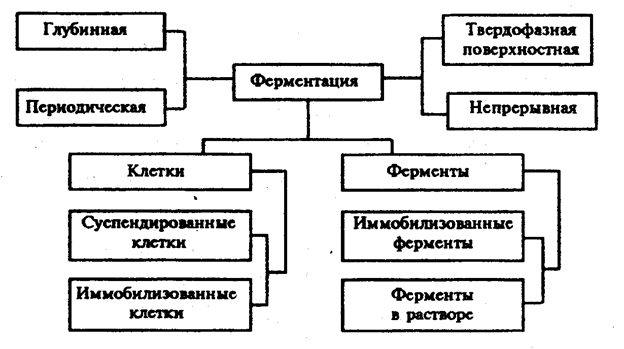 Рис. 10. Методы ферментации (Голубев В.Н., Жиганов И.Н., 2001).
Рис. 10. Методы ферментации (Голубев В.Н., Жиганов И.Н., 2001).
Сначала ферментер заполняют питательной средой, автоклавируют, а затем засевают чистой культурой, подаваемой из специального генератора. Для предотвращения контаминации (инфекции) в ферментере поддерживают повышенное давление наряду с оптимальными значениями рН, температуры, редокс-потенциала и другими условиями культивирования (рис. 11). В настоящее время наиболее прогрессивным признан проточный метод культивирования микроорганизмов, который обеспечивает непрерывную подачу в ферментер как питательной среды, так и посевного материала.

Рис.11. Принципиальная схема глубинного культивирования микроорганизмов (Т.А.Егорова и соавт., 2003): 1 – смеситель питательной среды; 2 – стерилизатор в непрерывном режиме потока питательной среды; 3,4 – теплообменники; 5 – посевные аппараты; 6, 10, 12 – фильтры для очистки воздуха; 7 – ферментер; 8,9 – насосы;
Микроорганизмы можно выращивать:
- в ферментере периодического действия (микроорганизмы выращивают без добавления свежей культуральной среды);
- в ферментере периодического действия с добавлением субстрата (периодически добавляют увеличивающиеся количества питательных веществ, но культуральную среду не удаляют до конца процесса);
- в непрерывной культуре (свежая культуральная среда поступает в ферментер непрерывно, и параллельно отводится такой же объем клеточной суспензии).
В ходе периодической ферментации различают шесть основных фаз роста:
- лаг-фазу (наблюдается, когда посевной материал получен из культуры, рост которой прекратился в результате исчерпания субстрата или ингибирования продуктом);
- фазу ускорения (скорость роста клеток увеличивается до достижения постоянной величины);
- логарифмическую (экспоненциальную) фазу (клетки претерпевают несколько делений, а удельная скорость роста остается постоянной);
- фазу замедления (кратковременная при истощении субстрата);
- стационарную фазу (биомасса остается постоянной, но метаболизм резко меняется – синтез вторичных метаболитов, например, антибиотиков);
- фазу отмирания (исчерпание энергетических запасов клетки и прекращение метаболизма).
Кривую роста в логарифмической фазе описывают математически. Прирост клеточной массы во времени dX/dt равен произведению удельной скорости роста μ на биомассу Х:
dX/dt= μ Х
Аналогично, прирост числа клеток dN/dt равен произведению удельной скорости μ на число клеток N:
dN/dt= μ N
Удельная скорость μ зависит от концентрации лимитирующего субстрата (источника углерода или азота) S, максимальной удельной скорости роста μмах и субстратспецифичной константы Кs:
μ=μмахS/ (Кs + S).
И S, и Кs имеют размерность г/л или моль.
Иногда вместо удельной скорости роста используют время удвоения, или время генерации td=ln2/μ. Это время, за которое в определенных условиях число клеток или биомасса удваиваются. Для одноклеточных микроорганизмов величина μмах обычно находится в диапазоне 2,1-0,086 ч-1, что соответствует времени удвоения примерно от 20 мин до 8 ч. Когда субстрат присутствует в избытке (т.е. при S>> Кs), μ= μмах и достигается максимальная скорость роста культуры в экспоненциальной фазе. Как правило, величина Кs настолько мала, что концентрация субстрата редко становится сравнимой с Кs во время экспоненциальной фазы. Например, в случае E. coli Кs для глюкозы равна примерно 1 мг/мл, а начальная концентрация глюкозы в среде обычно составляет около 10000 мг/л. Однако в конце экспоненциальной фазы субстрата остается мало, и S может стать ниже Кs (в этом случае быстро наступает фаза замедления).
Периодическая культура с добавлением субстрата – в ферментер периодически добавляют субстрат, а конечный продукт собирают только по завершении процесса. Добавление субстрата приводит к удлинению экспоненциальной и стационарной фаз и к увеличению биомассы и количества метаболитов, синтезируемых во время стационарной фазы (например, антибиотиков). Однако в стационарной фазе микроорганизмы часто синтезируют протеолитические ферменты, разрушающие все производимые ими белки. Поэтому в случае получения белка как целевого продукта, следует остановить процесс до его перехода в стационарную фазу. Периодическую ферментацию с добавлением субстрата можно использовать для культивирования не только микроорганизмов, но и клеток млекопитающих и насекомых.
При непрерывной ферментации стационарные условия обеспечиваются тем, что при постоянном объеме биореактора убыль числа клеток (удаление продукта) в точности уравновешивается их увеличением в результате деления. Чтобы получить непрерывную культуру с постоянными гидродинамическими характеристиками, нужно создать условия, при которых удельная скорость роста была бы ниже максимальной величины μмах. Для этого нужна тщательная регулировка насоса подачи, чтобы объем культуры в биореакторе поддерживался постоянным. Получение продукта в ферментере непрерывного типа дешевле, чем в периодических из-за уменьшения объема биореактора, отсутствия простоя и сохранения физиологического статуса культивируемых клеток на одинаковом уровне. Непрерывная ферментация может продолжаться 500-1000 ч, что создает проблему поддержания стерильности промышленной установки.
В таблице 5 приведены основные факторы среды, определяющие рост и биосинтетическую активность продуцентов.
Таблица 5 - Факторы среды, определяющие функционирование продуцентов (по В.Н.Голубеву и И.Н.Жиганову, 2001)
| Фактор | Роль при культивировании | Методы управления |
| Состав и кон-центрация пи-тательных ве-ществ | Обеспечивают метаболизм | Составление оптимальной композиции; подпитка во время ферментации; непре- рывность процесса; много-стадийность с учетом потреб-ностей продуцента по фазам развития и др. |
| Концентрация продукта и ингибиторов | Замедляет биохимические реакции | Осаждение продукта по мере накопления; ферментация с диализом; ферментация под разрежением с испарением летучего продукта и др. |
| рН | Оптимизирует скорости биохимических реакций (пределы рН 3,5-9,0) | Регулирование путем добавления кислоты или щелочи |
| Температура | Оптимизирует скорость биохимических реакций (20-70 ˚С) | Охлаждение или подогрев культуральной жидкости при помощи теплообменников или температуры подаваемых в биореактор субстратов |
| Осмотическое давление или активность воды | Определяет границы жизни (0,6-0,998) | Составление сред с оптимальной концентрацией питательных веществ или влажностью твердой среды; поддержание на постоянном уровне во время ферментации путем разбавления водой или добавления отдельных компонентов |
| Содержание растворенного кислорода | Для аэробов обеспечивает аэробный метаболизм; является акцептором Н+; ингибирует развитие анаэробов | Для аэробных процессов регулируют интенсивностью аэрации или добавлением к газовой смеси кислорода; при атмосферном давлении и 20 ˚С в 1 л среды растворяется 0,28 ммоль (0,008 г/л) О2. Анаэробные процессы реализуют в бескислородной среде, что достигается продуванием N2 и СО2 или добавками восстановителей (цистеина, аскорбиновой кислоты и др.) |
| Содержание диоксида углерода | Равномерное распределение питательных веществ и биомассы по всему пространству среды | Организуют макро- и микроперемешивание в биореакторах при помощи механических мешалок, барботажных, циркуляционных и других систем. Аэрация способствует перемешиванию, а пенообразование – флотации продуцента; флокуляция способствует осаждению биомассы |
| Вязкость среды | Определяет диффузию питательных веществ и перемешивание клеток продуцента | Регулирование компонентами питания, характером и концентрацией биомассы, а также наличием некоторых полимерных экстрацеллюлярных продуктов. Вязкость влияет на перемешивание и аэрацию, для чего требуются специальные технические средства |
Культуры с высокой плотностью. Считают, что при получении белков максимальный выход конечного продукта напрямую связан с плотностью культуры клеток. В ферментерах периодического действия с добавлением субстрата концентрация рекомбинантных клеток E.coli достигает 50 г сухого вещества на 1 л среды (в некоторых случаях >100 г/л). Заметим, что вес сухого вещества клеток E.coli составляет примерно 20-25% веса влажного вещества. Один из способов повышения плотности культуры состоит в регулировании культуральной среды. Известно, что избыточное введение питательных веществ, например источников углерода, тормозит рост клеток при концентрациях: глюкоза >50 г/л, аммиак >3 г/л, железо >1,15 г/л, магний >8,7 г/л, фосфор >10 г/л, цинк >0,38 г/л. В культурах с высокой плотностью может возникнуть недостаток кислорода (усилить подачу воздуха, заменить воздух на кислород или экспрессировать в клетках E.coli ген гемоглобина Vitreoscilla, обладающего большим сродством к кислороду. Высокой плотности чаще всего удается достичь при росте в периодическом режиме с добавлением субстрата. Режим подачи питательных веществ может быть непрерывным, ступенчатым или экспоненциальным.
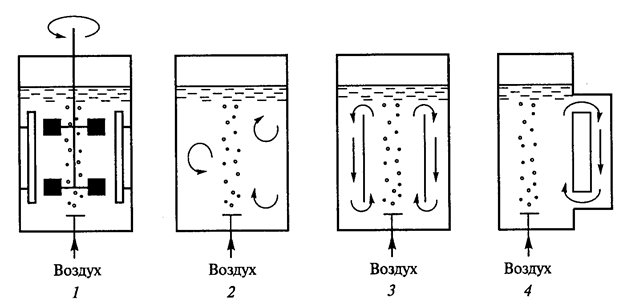
Рис. 12. Схема работы основных типов биореакторов (Т.А.Егорова и соавт., 2003): 1) биореактор с механическим перемешивающим устройством; 2) барботажный биореактор; 3) аэролифтный биореактор; 4) биореактор с вынесенной циркуляционной петлей
Биореакторы делят на три основных группы (рис.12):
- реакторы с механическим перемешиванием;
- барботажные колонны, через которые для перемешивания содержимого пропускается воздух или другой газ;
- аэролифтные (эрлифтные) реакторы с внутренней или внешней рециркуляцией; перемешивание и циркуляция культуральной среды в них обеспечивается потоком газа (обычно воздуха), за счет которого между верхним и нижним слоями культуральной среды возникает градиент плотности.
Чаще всего используются биореакторы с механическим перемешиванием, поскольку они имеют следующие преимущества:
- позволяют легко менять технологические условия;
- всегда есть в продаже;
- обеспечивают эффективную доставку газа к растущим клеткам (если говорить на инженерном языке, обладают высоким объемным коэффициента массобмена);
- имеется большой опыт их промышленного использования с соответствующей регламентационной литературой.
В реакторах с механическим перемешиванием газ (как правило, воздух) подают в культуральную среду под давлением через разбрызгиватель – кольцо с множеством маленьких отверстий либо трубку с одним отверстием. В первом случае образуются мелкие пузырьки воздуха и обеспечивается их более равномерное распределение, однако разбрызгиватели в виде трубок используются чаще, поскольку они реже закупориваются. Для равномерного распределения газа по всему объему биореактора используются мешалки – одна или несколько. Они разбивают крупные пузырьки воздуха, разносят их по всему реактору и увеличивают время пребывания в культуральной среде. Многие культуральные среды агрессивны, поэтому стенки биореакторов делают из нержавеющей стали. Стеклянные части используют только в лабораторных биореакторах емкостью менее 50 л. Размер биореактора лимитируется его способностью эффективно отдавать тепло, выделяемое микроорганизмами в ходе метаболизма и высвобождаемое в результате перемешивания. Известно, что, ассимилируя 1 кг сахара, микроорганизмы выделяют 4-6 тысяч кДж тепла.
Обеспечение стерильности, постоянства рН и температуры – ключевые требования при любом способе культивирования независимо от конструкции биореактора.
В молекулярной биотехнологии биореакторы с механическим перемешиванием используются в меньшей степени из-за грубого воздействия на клетки:
- клетки рекомбинантных микроорганизмов более хрупки, чем нетрансформированные клетки, поскольку часть их энергетических ресурсов расходуется на синтез чужеродных белков и в результате образуется менее прочная клеточная стенка;
- самый распространенный ответ клетки на внешнее воздействие – уменьшение количества синтезируемых белков, в том числе и рекомбинантных;
- под действием сдвиговых эффектов могут изменяться физические и химические свойства клеток, что затруднит дальнейшую работу с ними, например, может увеличиться количество полисахаридов на поверхности клеток (это приведет к ухудшению условий их выделения и лизиса, а также затруднит очистку рекомбинантного белка).
Рекомбинантные микроорганизмы широко используются для получения разнообразных белковых продуктов, применяющихся в медицине (например, инсулина), а также в качестве своего рода «фабрик» по производству имеющих коммерческую ценность метаболитов (например, антибиотиков). Белки синтезируются наиболее интенсивно от середины экспоненциальной фазы до ее завершения, а метаболиты – в период замедления роста и в стационарной фазе.
Выделение целевого продукта следует за этапом ферментации.
1. Отделение клеток от культуральной жидкости после ферментации осуществляют методами скоростного центрифугирования или фильтрацией. Центрифугирование не всегда доступно из-за стоимости оборудования; метод фильтрации не всегда эффективен из-за снижения фильтрационной способности пористого материала, заполняемого клетками.
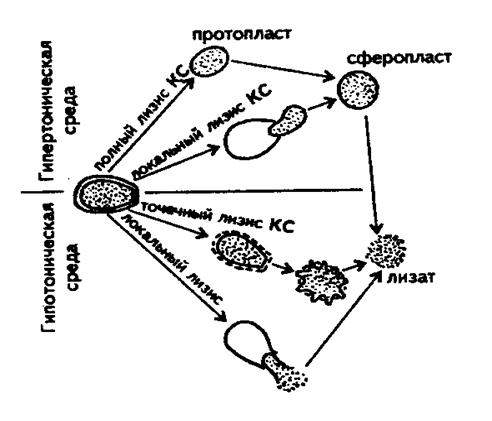
Рис. 13. Схема ферментативного лизиса дрожжевой клетки (Кислухина О.В., 2002).
2. Выделение продукта зависит от его локализации. Если продукт представляет собой белок, находящийся в культуральной среде, то среду концентрируют, а белок очищают хроматографическими или другими препаративными методами. Если продукт – это низкомолекулярное соединение, находящееся в культуральной среде, то используют соответствующие методы экстракции. Если продукт имеет внутриклеточную локализацию, то прежде чем очищать его, клетки разрушают.
3. Разрушение клеток осуществляют химическими, биологическими и физическими методами. В качестве примера приведена схема ферментативного лизиса дрожжевой клетки (рис.13). При проведении лизиса в гипертонической среде и высокой активности литических ферментов клеточная стенка может быть полностью лизирована, и из клетки образуется протопласт, принимающий затем сферическую форму. При перенесении в гипотоническую среду сферопласты мгновенно лизируются под действием осмотических сил.
Все процедуры должны быть достаточно жесткими, чтобы разрушить клеточную стенку, и в то же время достаточно мягкими, чтобы исключить денатурацию белка. В связи с разным строением клеточных стенок у разных микроорганизмов существуют разные подходы к их разрушению:
- У грамположительных бактерий клеточная стенка состоит из толстого пептидогликанового слоя N-ацетилмурамовой кислоты, соединенных пептидными мостиками.
- У грамотрицательных бактерий клеточная стенка тоньше и покрыта снаружи слоем липидов.
- Стенка дрожжевых клеток состоит из плотного слоя частично фосфорилированных маннанов и β-гликанов.
- Низшие грибы имеют многослойные клеточные стенки, состоящие из α- и β-гликанов, гликопротеинов и хитина.
Химические методы разрушения – обработка щелочью, органическими растворителями или детергентами. Все эти методы не должны отрицательно влиять на целевой белковый продукт. Основной биологический метод разрушения клеток микроорганизмов является лизис с помощью ферментов. Лизоцим яичного белка легко гидролизует клеточные стенки грамположительных бактерий, для лизиса грамотрицательных бактерий к яичному лизоциму добавляют этилендиаминотетрауксусную кислоту (ЭДТА, трилон Б). Клеточные стенки дрожжей гидролизуют с помощью одного или нескольких ферментов – β-1,3-глюканазы, β-1,6-глюканазы, манназы и хитиназы. Ферментативная обработка высокоспецифична, а лизис проходит в мягких условиях, но сдерживает их применение высокая стоимость. Дешевле клетки разрушать с помощью физических методов – осмотический шок, замораживание-оттаивание, ультразвуковая обработка. Для разрушения большого количества клеток используют шаровые мельницы. При гомогенизации под высоким давлением концентрированную клеточную суспензию продавливают через небольшое отверстие под высоким давлением, а затем давление резко сбрасывают, что вызывает лизис. В методе соударения клеточную суспензию большой вязкости направляют под давлением на неподвижную поверхность или навстречу потоку другой суспензии. В месте соприкосновения выделяется большое количество энергии, разрушающей клетки. Эффективно сочетание метода обработки лизоцимом с соударением (с уменьшением дозы и скорости струйного выброса) для сохранения нативности целевого продукта.
4. Затем следуют этапы очистки белка, а если получен нерастворимый продукт, то его солюбилизации обычными приемами препаративной биохимии.
Оценка процесса ферментации осуществляется путем анализа ряда кинетических показателей. Практически в ферментационной среде контролируют содержание основных субстратов (обычно источник углеводов), биомассы и целевого продукта. По этим показателям вычисляют удельную скорость роста, продуктивность системы по биомассе и продукту, а также экономические коэффициенты (таблица 6).
Биотехнологические штаммы микроорганизмов.Микроорганизмы, способные синтезировать определенный продукт в количествах, превосходящих физиологические потребности (сверхсинтез), часто встречаются в природе. Некоторые из них при выделении в окружающую среду оказываются токсичными для других видов (органические кислоты, спирты, антибактериальные вещества) и служат средством защиты. Микроорганизмы с такими свойствами были первыми привлечены к хозяйственной деятельности человека. В настоящее время природные штаммы микроорганизмов используют для производства микробной биомассы (микробного белка), бактериальных азотистых удобрений, биопестицидов, пищевых продуктов. Однако большинство промышленных микроорганизмов представлено искусственно селектированными штаммами.
Таким образом, в промышленности применяют три вида штаммов: природные штаммы, улучшенные естественным или искусственным отбором; штаммы, измененные в результате индуцированных мутаций, и штаммы культур, полученные методами генной или клеточной инженерии. В таблице 7 представлены некоторые группы микроорганизмов, используемые для промышленного синтеза веществ.
Экологически чистая энергия. Биогаз. В настоящее время очевидно, что окружающая среда – воздух, земля вода – уже не могут эффективно «перерабатывать» бытовые, промышленные и сельскохозяйственные отходы. Поэтому создан ряд технологических, включая биотехнологические, подходов, с помощью которых планируется перерабатывать большие количества отходов (например, лигноцеллюлозы) и токсических веществ.
Таблица 6 – Количественные характеристики процесса ферментации
Заимствовано из монографии: В.Н.Голубев, И.Н.Жиганов Пищевая биотехнология, 2001.
Определим основные термины:
- биодеградация разрушение отходов, попавших в окружающую среду, с помощью живых микроорганизмов;
- биомасса – совокупность веществ и материалов – побочных продуктов пищевой и перерабатывающей промышленности, - которые раньше считались отходами, а теперь могут служить сырьем для производства многих важных для народного хозяйства продуктов.
Таблица 7 – Продуценты и продукты промышленного биосинтеза

(Таблица заимствована из монографии Голубева В.Н. и Жиганова И.Н., 2001).
Экологически чистую энергию можно получать путем преобразования солнечной энергии в электрическую с помощью солнечных коллекторов, использования энергии ветра, приливов, а также из биогаза и микробного этанола. По Т.А.Егоровой и соавт. (2003) биогаз – это смесь из 65% метана, 30% СО2 , 1% сероводорода и незначительных примесей азота, кислорода, водорода и угарного газа. Энергия, заключенная в 28 м3 биогаза, эквивалентна энергии: 16,8 м3 природного газа; 20,8 л нефти: 18,4 л дизельного топлива. В основе получения биогаза лежит процесс метанового «брожения». Биометаногенез – сложный микробиологический процесс, в котором органическое вещество разлагается до диоксида углерода и метана в анаэробных условиях. Микробиологическому анаэробному разложению поддаются практически все соединения природного происхождения, а также значительная часть ксенобиотиков органической природы. В анаэробном процессе биометаногенеза выделяют три последовательные стадии, в которых участвуют свыше 190 различных микроорганизмов. На первой стадии под влиянием экстрацеллюлярных ферментов ферментативному гидролизу подвергаются сложные многоуглеродные соединения – белки, липиды и полисахариды. Вместе с гидролитическими бактериями функционируют и микроорганизмы-бродильщики, которые ферментируют моносахариды, органические кислоты. На второй стадии (ацидогенез) в процессе ферментации участвуют две группы микроорганизмов: ацетогенные и гомоацетогенные. Ацетогенные Н2-продуцирующие микроорганизмы ферментируют моносахариды, спирты и органические кислоты с образованием Н2, СО2, низших жирных кислот, в основном ацетата, спиртов и некоторых других низкомолекулярных соединений. Деградация бутирата, пропионата, лактата с образованием ацетата происходит при совместном действии ацетогенных Н2-продуцирующих и Н2-утилизирующих бактерий. Гомоацетатные микроорганизмы усваивают Н2 и СО2, а также некоторые одноуглеродные соединения через стадию образования ацетил-КоА и превращения его в низкомолекулярные кислоты (в основном, в ацетат). На заключительной третьей стадии анаэробного разложения отходов образуется метан. Он может синтезироваться через стадию восстановления СО2 молекулярным водородом, а также из метильной группы ацетата. Некоторые метановые бактерии способны использовать в качестве субстрата формиат, СО2, метанол, метиламин и ароматические соединения:
4Н2 + СО2 → СН4 + 2Н2О
3Н2 +СО → СН4+ Н2О
2Н2О + 4СО → СН4 + 3СО2
4НСООН → СН4 + 3СО2 + 2Н2О
4СН3ОН → 3СН4 + СО2 + 2Н2О
СН3СООН → СН4 + СО2
Метанобразующие бактерии 90-95% углерода субстратов превращают в метан. На рисунке 14 представлена схема устройства реактора (метантенка) для обработки сельскохозяйственных отходов (навоз, остатки растениеводства).

Рис. 14. Схема устройства реактора для обработки сельскохозяйственных отходов (Егорова Т.А. и соавт., 2003).
Процесс метанообразования ведется при 30-60 ºС и рН 6-8. В настоящее время для производства биогаза чаще используют вторичные отходы (отходы животноводства и сточные воды городов), чем первичные (отходы зерноводства, полеводства, пищевой, микробиологической, лесной промышленности). Использование термофильных метанобразующих бактерий позволяет вести процесс при 50-60 ºС, что обеззараживает субстрат метанообразования от патогенной микрофлоры и гельминтов. В целом анаэробная конверсия органических отходов в метан – наиболее конкурентноспособная область биоэнергетики. Основное преимущество биогаза состоит в том, что он является возобновляемым источником энергии, связанным с существованием жизни на земле.
Деградация ксенобиотиков с помощью микроорганизмов. На протяжении 20 века нарастало загрязнение окружающей среды ксенобиотиками (неприродные, синтетические химические вещества; от греч. Xenos, чужой) – гербицидами, пестицидами, хладоагентами, растворителями и т.д. Традиционные методы разрушения, сжигания или химической модификации ксенобиотиков приводили к дальнейшему загрязнению окружающей среды. Определенный позитивный сдвиг в технологиях борьбы с химическим загрязнением окружающей среды проявился в середине 60-х годов прошлого века, когда были обнаружены почвенные микроорганизмы, способные к деградации ксенобиотиков.
Основную группу почвенных микроорганизмов, разрушающих ксенобиотики, составляют бактерии рода Pseudomonas, разные штаммы которых способны расщеплять более 100 органических соединений. Нередко один штамм использует в качестве источника углерода несколько родственных соединений.
В биодеградации сложной органической молекулы обычно участвуют несколько ферментов. Кодирующие их гены входят в состав крупных (50-2000 т.п.н.) плазмид, а иногда обнаруживаются как в хромосомной, так и в плазмидной ДНК.
Бактерии, разрушающие негалогенированные ароматические соединения, как правило, превращают их в катехол или протокатехоат, а затем в ходе нескольких реакций окислительного расщепления, - в ацетил-КоА и сукцинат или в пируват и ацетальдегид. Полученные вещества легко метаболизируются всеми микроорганизмами. Галогенированные ароматические соединения (пестициды, гербициды) деградируются теми же ферментами, но скорость их превращений зависит от числа атомов галогена в исходном ксенобиотике. Дегалогенирование происходит с помощью неспецифической диоксигеназной системы микроорганизмов.
Некоторые микроорганизмы обладают природной способностью к деградации различных ксенобиотиков; следует иметь в виду, что:
- ни один из микроорганизмов не может разрушать все органические соединения;
- некоторые органические соединения в высокой концентрации подавляют рост деградирующих их микроорганизмов;
- обычное загрязнение окружающей среды многокомпонентное, когда один из компонентов может подавлять жизнедеятельность деградирующих другие соединения микроорганизмов.
Заманчиво создать штамм микроорганизмов, способный утилизировать несколько органических веществ-ксенобиотиков. Для этого используют два подхода.
1. Метод конъюгации обеспечивал перенос из клетки в клетку целых плазмид. А.М.Чакрабарти, проводивший эксперименты по переносу плазмид-разрушительниц, т.е. плазмид, кодирующих все ферменты пути биодеградации определенного соединения, сконструировал штамм, содержащий несколько таких плазмид. Кодируемые плазмидными генами ферменты каждого катаболического пути разрушали определенное органическое соединение. Взяв четыре разные бактерии, он создал один микроорганизм, содержащий плазмиды, которые обусловливали деградацию камфары, октана, салицилата, нафталина (супербацилла была запатентована спустя 11 лет в США). Большинство разрушающих ксенобиотики бактерий, модифицированных путем переноса плазмид, являются мезофильными микроорганизмами (хорошо растут при 20-40 ˚С), а температура воды в загрязненных реках, озерах и океанах лежит в диапазоне от 0 до 20 ˚С. Поэтому плазмиду TOL (детерминирует разрушение толуола) мезофильного штамма Pseudomonas putida перенесли с помощью конъюгации в психрофильный (с низким температурным оптимумом) штамм, утилизирующий салицилат при температуре, близкой к 0 ˚С. Трансформированный штамм оказался способным утилизировать салицилат и толуол в качестве источника углерода при 0 ˚С.
Date: 2015-09-27; view: 2302; Нарушение авторских прав