
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Пример 2
|
|
Пользуясь следующими данными: ΔНо6р(СО2) = –393,5 кДж/моль; ΔHo6p(МgO) =– 601,8 кДж/моль, определить тепловой эффект реакции:
2Mg(к.) + СО2(г.) = 2МgО(к.) + С(графит); ΔHx=?
Решение: Пользуясь следствием из закона Гесса можно сразу записать требуемое выражение:
ΔНx = 2ΔНо6р(MgO) – ΔНо6р(СО2).
Проделайте арифметические действия самостоятельно и получите результат: ΔНx = – 801,1 кДж/моль.
Рассмотрим тепловые эффекты некоторых процессов, интересных для химика. Теплоты образования различных веществ обычно имеют значения в интервале от –1500 кДж/моль до + 500 кДж/моль, т.е. тепловой эффект реакции образования может быть как экзо- так и эндотермическим. Вещества, имеющие большие значения ΔНобр обладают значительным запасом внутренней энергии и поэтому являются неустойчивыми и реакционноспособными. Напротив, вещества с малыми, особенно отрицательными значениями ΔНобр являются, как правило, относительно инертными в химическом отношении. Сравните следующие величины: ΔНобр(С2Н2) = +226,8 кДж/моль и ΔНобр(СО2) = –393,5 кДж/моль. Нетрудно догадаться, какое извеществ является более устойчивым. Теплоты образования родственных соединений (например, оксидов элементов одной подгруппы периодической системы) часто подчиняются определенным закономерностям, которые вытекают из периодического закона Д.И. Менделеева.
Теплоты сгорания характеризуют тепловой эффект реакции взаимодействия веществ с кислородом при образовании, как правило, высших оксидов. Они, чаще всего, имеют отрицательные значения, и чем эти величины больше по абсолютной величине, тем эффективнее использование данного вещества в качестве топлива.
К химическим реакциям можно отнести и процессы распада ионных кристаллов на газообразные ионы. Например:
CsF(т.) = Cs+(г.) + F–(г.); ΔН = +762 кДж.
Тепловой эффект процессов такого рода называется энергией кристаллической решетки. Чем выше это значение, тем прочнее решетка кристалла, тем больше энергетические затраты на ее разрушение в процессе химического взаимодействия, тем инертнее ведет себя такое веществе в химическом отношении.
Тепловые эффекты процессов перехода из одного агрегатного состояния в другое (твердое → жидкое; жидкое → газообразное) обычно имеют значения до 100 кДж/моль. Подумайте, почему эти величины имеют положительные значения?
Процесс растворения вещества в воде также может сопровождаться тепловым эффектом. Теплоты растворения твердых кристаллических веществ чаще имеют положительные значения (ΔН>0), а теплоты растворения газов, наоборот – отрицательные (ΔН <0). Подумайте и постарайтесь объяснить эту закономерность самостоятельно.
3. Энтропия. Движущее начало
химических процессов.
Убедившись в полезности знания тепловых эффектов химических превращений, мы, тем не менее, не смогли ответить на вопрос: «Почему одни химические реакции возможны, а другие нет?». Что же является движущим началом любого химического превращения?
Первой попыткой ответить на этот вопрос можно считать сформулированный в 1867 году принцип Бертло - Томсена, согласно которому самопроизвольно протекают только экзотермические реакции, т.е. с DН<0.
Авторы этого положения не без основания полагали, что движущим началом химической реакции должно быть стремление системы к минимуму внутренней энергии.
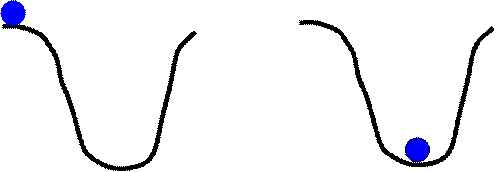 |
На рисунке показана механическая аналогия правила Бертло - Томсена. Шарик может самопроизвольно скатиться в ямку и это происходит за счет уменьшения его потенциальной энергии. Обратный же процесс - самопроизвольный подъем из ямки наверх невозможен.
Действительно, для многих реакций, в частности в конденсированной фазе (жидком и твердом состоянии) данный принцип выполняется.
Однако очень скоро обнаружилась ограниченность применимости этого положения. В первую очередь это касалось реакций с участием газообразных веществ. Оказалось, что значительное число реакций, эндотермических по тепловому эффекту, тем не менее, протекают самопроизвольно.
Такая ситуация потребовала от термодинамики поиска более общего критерия самопроизвольности протекания химических процессов.
Для решения этого вопроса надо ввести новую функцию состояния – энтропию S. Физический смысл данной функции можно рассмотреть на примере расширения газа. Рассмотрим идеальный газ в сосуде, разделенном перегородкой на два отделения.
 |
Если в первый момент времени газ занимает только одну половину сосуда, то после удаления перегородки, газ самопроизвольно займет весь объем. При этом процесс будет эндотермическим. На данном принципе и действует обычный холодильник. Рассмотренное явление противоречит принципу Бертло - Томсена. В нашем случае произошел, как говорят в термодинамике, переход системы в более разупорядоченное состояние.
Мерой разупорядочивания (беспорядка) и является величина функции энтропии S. Как и любая термодинамическая функция состояния, она не зависит от пути перехода из одного состояния в другое. Движущим началом, в данном случае, является стремление системы к более разупорядоченному состоянию, а мерой беспорядка и является энтропия.
Это можно сформулировать как второе начало термодинамики:
В изолированной системе самопроизвольно могут протекать процессы, сопровождающиеся возрастанием энтропии DS>0.
Энтропия связана с термодинамической вероятностью соотношением:
S = k · ln W, (12)
где k – константа Больцмана,
W – термодинамическая вероятность.
Разберем понятие термодинамической вероятности подробнее. Для этого введем понятия микро - и макросостояния.
Микросостояние характеризуется совокупностью всех параметров, описывающих все частицы данной системы (координата, скорость энергия и т.п.).
Макросостояние характеризуется параметрами всей совокупности частиц системы, то есть термодинамическими параметрами (давление, температура, количество вещества и т.п.).
Как правило, число микросостояний, отвечающих данному макросостоянию огромно. Действительно, несмотря на постоянное перемещение и соударение молекул в самой простой системе (газ в сосуде) и изменение параметров каждой частицы – макропараметры такой системы (температура, объем, давление и т.д.) могут оставаться неизменными.
Термодинамической вероятностью называется количество равновероятных микросостояний, соответствующих данному макросостоянию.
Можно провести аналогию, которая позволит лучше понять смысл термодинамической вероятности. Для этого вспомним одну из простейших азартных игр – кости. Играющие бросают определенное количество костей (например, три) и по сумме выпавших очков определяют победителя.
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 |
Микросостоянием будем считать показания на каждой из костей, а макросостоянием – сумму очков на трех костях.
Для следующего примера микросостоянием является следующий набор
чисел: 6 1 3, а макросостоянием является сумма, равная 10.


 Теперь посмотрим, каким количеством микросостяний можно получить то или иное макросостояние. Например, сумму 18, равно, как и сумму 3 можно получить только одной из показанных ниже комбинаций:
Теперь посмотрим, каким количеством микросостяний можно получить то или иное макросостояние. Например, сумму 18, равно, как и сумму 3 можно получить только одной из показанных ниже комбинаций:
 | |||||||
 | |||||||
 | |||||||
 | |||||||
Таким образом, данное макросостояние можно получить только с помощью одного микросостояния. Но если нас интересует сумма 10, то ее можно получить уже многими способами, некоторые из которых показаны ниже:
 |  | ||||||||||
 | |||||||||||
 | |||||||||||
 | |||||||||||
 | |||||||||||





 Можно сделать вывод, что состояние со значением суммы очков равным 10 является более вероятным, чем состояние со значением суммы равным 18 или 3.
Можно сделать вывод, что состояние со значением суммы очков равным 10 является более вероятным, чем состояние со значением суммы равным 18 или 3.
Нечто подобное имеет место и в природе. Происходят только такие события, которые являются наиболее вероятными, т.е. реализуются большим числом микросостояний. Если же вспомнить, что в примере с газом в сосуде, молекул отнюдь не три, а значительно больше, го можно понять, почему газ самопроизвольно занял весь объем, а не собрался, к примеру, только в одной половине. Произошло просто термодинамически наиболее вероятное событие.
Конечно, теоретически можно предположить, что произойдет обратный процесс, т.е. молекулы газа вдруг соберутся в одной половине сосуда самопроизвольно. Однако вероятность такого события столь мала, что никто до сих пор ничего подобного не наблюдал.
Энтропию относят к 1 молю вещества, обозначают символом S, а в стандартных условиях – Sº298, и выражают в условных энтропийных единицах: э.е. = Дж/(моль • град). В тех же единицах выражают и изменение энтропии в ходе процесса, которое соответственно обозначают ΔS и ΔSº298. Последние представляют собой разность энтропий конечного и начального состояний вещества, а в более общем случае – разность суммы энтропий продуктов реакции и суммы энтропий исходных веществ с учетом их состояния.
Значение энтропии сильно зависит от различных факторов. С ростом температуры энтропия возрастает. Особенно сильно изменяется энтропия при переходе от одного агрегатного состояния к другому. Газообразное состояние более упорядочено, чем жидкое, поэтому превращение жидкости в газ сопровождается увеличением энтропии. Энтропия жидкости больше энтропии того же вещества в твердом состоянии. В таблице 1 указаны значения энтропии для различных агрегатных состояний воды.
Таблица 1. Энтропии для различных агрегатных состояний воды.
| Фаза Н2О | |||
| Н2О (к.) | Н2О (ж.) | Н2О (г.) | |
| Sº(энтр. ед.) | 39,4 | 70,1 | 188,7 |
Энтропия простых твердых веществ зависит от строения их аллотропных модификаций. Структура алмаза, например, более упорядочена, чем структура графита, и энтропии их составляют: Sº298(ал.) = 2,4 э.е.; Sº298(гр.) = 5,7 э.е.
Энтропия также зависит от числа частиц в системе. Как видно из таблицы 2, число атомов кислорода в обоих случаях одинаково, но существуют они в различных состояниях. Подобное изменение энтропии может происходить и при растворении твердого вещества. Объясните изменение энтропии в этом случае.
Таблица 2.Зависимость энтропии от числа частиц в системе.
| Количество вещества | ||
| 1 моль О3 | 3 моля О | |
| Sº(энтр. ед.) | 239,1 | 483,6 |
Если количество частиц в системе одинаково, то многое зависит от сложности строения этих частиц (таблица 3). Здесь указаны значения энтропии для одного моля каждого типа частиц.
Таблица 3. Зависимость энтропии от строения частиц в системе.
| Число частиц | |||
| О | О2 | О3 | |
| Sº(энтр. ед.) | 162,4 | 205,0 | 239,1 |
Энтропия также существенно зависит от молекулярной массы частиц. В таблице 4приведены значения энтропии для одного моля каждого из галогенов.
Таблица 4. Зависимость энтропии от молекулярной массы частиц.
| Частицы | ||||
| F2 | Cl2 | Br2 | I 2 | |
| Sº(энтр. ед.) | 200,9 | 222,9 | 247,0 | 259,6 |
Во всех случаях значение энтропии было выражено положительными числами, что не удивительно, если вспомнить определение энтропии. Однако не совсем понятно, от какого значения надо вести отсчет термодинамической вероятности.
Ответ на этот вопрос дает третье начало термодинамики:
Энтропия S равна нулю, и следовательно, термодинамическая вероятность W равна единице, при температуре абсолютного нуля (0 К) у идеально чистого и правильного кристалла.
Таким образом, для предсказания направления протекания химической реакции требуется учитывать не только энтальпийный, но и энтропийный фактор. Можно сказать, что термодинамическая система испытывает противоречивое стремление: с одной стороны, перейти в состояние с меньшей внутренней энергией, а, с другой стороны, перейти в состояние с наибольшей разупорядоченностью. В термодинамике была введена новая функция состояния, учитывающая оба эти стремления и названная свободной энергией Гиббса
G = H – T • S (13)
Она называется иначе изобарно-изотермическим потенциалом, что указывает на состояние системы (постоянное давление и постоянная температура). При этих условиях критерием самопроизвольности протекания процесса будет отрицательное значение изменения свободной энергии Гиббса, т.е. стремление к минимуму этой величины
ΔG = ΔH – TΔS < 0. (14)
Если ΔG < 0, то процесс может протекать самопроизвольно, если ΔG > 0 – процесс самопроизвольно при данных условиях протекать не может.
Поскольку функция G состоит из двух членов, то возможны четыре типичных случая:
1. ΔН < 0 (процесс экзотермический), ΔS > 0. Подставив эти величины в формулу (14), получим, что ΔG < 0, притом всегда. Такой процесс возможен при любых температурах.
2. ΔН > 0 (процесс эндотермический), ΔS < 0. Для таких реакций ΔG > 0 всегда, при любых температурах. Такой процесс невозможен ни при каких условиях.
3. ΔН < 0, ΔS < 0. Такой процесс возможен, если выполняется условие: | ΔН | > |T•ΔS|. В этом случае можно добиться выполнения условия ΔG < 0 при низких температурах. Следовательно, и процессы могут протекать самопроизвольно при низких температурах.
4. ΔН > 0; ΔS > 0. Такой процесс возможен, если выполняется условие: |ΔН | < | T•ΔS |. В этом случае условие ΔG < 0 может выполняться при высоких температурах, и для протекания химического процесса надо создавать именно такие условия.
Пример 3. Указать, какие из перечисленных реакций и при каких условиях могут протекать самопроизвольно:
– 2N2(г.) + O2(г.) = 2N2O(г.); ΔН > 0
– N2(г.) + O2(г.) = 2NO(г.); ΔН > 0, ΔS ≥ 0
– 2NO(г.) + O2(г.) = 2NO2(г.); ΔН > 0
– NO(г.) + NO2(г.) = N2O3(ж.); ΔН > 0
– N2(г.) + 2O2(г.) = 2NO2(г.); ΔН > 0
Решение: В первом случае происходит уменьшение числа газообразных частиц в системе, следовательно, энтропия уменьшается ΔS < 0. С учетом теплового эффекта реакции (ΔН > 0) делаем вывод, что ΔG > 0 всегда. Поэтому такой процесс не может самопроизвольно протекать ни при каких условиях.
Во втором случае изменение энтропии очень мало, так как в процессе химического превращения число частиц не изменяется, зато продукт обладает несколько большим значением энтропии, чем исходные вещества, т.е. ΔS ≥ 0. Данная реакция может протекать самопроизвольно, но при очень высоких значениях температуры.
Рассмотрим еще четвертую реакцию. Здесь изменение энтропии ΔS <0 (cамостоятельно докажите это), а тепловой эффект отрицательный ΔН <0. В таком случае ΔG < 0 при низких температурах. Действительно, оксид азота (Ш) можно получить из двух других оксидов азота только при очень низкой температуре в виде жидкости синего цвета. При повышении температуры это вещество самопроизвольно разлагается.
Оставшиеся два случая проанализируйте самостоятельно. Обратите внимание на тепловые эффекты приведенных выше реакций. Сделайте вывод об устойчивости оксидов азота.
Часто бывает необходимо найти условия, при которых тот или иной процесс может протекать самопроизвольно.
Пример 4. Вычислить ΔG реакцииСаСO3(т.) = СаО(т.) + СО2(г.).
для температур 25, 500, и 1500°С, пользуясь табличными значениями и пренебрегая зависимостью термодинамических величин от температуры.
Таблица 5.
| ΔНобр (кДж/моль) | Sобр(Дж/моль• К) | ΔGобр (кДж/моль) | |
| СаСO3(т.) | – 1207,0 | 88,7 | – 1127,7 |
| СаО(т.) | – 635,5 | 39,7 | – 604,2 |
| СО2(г.) | – 393,5 | 213,7 | – 394,4 |
Решение:
Поскольку в таблице 5 указаны стандартные значения термодинамических величин, то для первого условия величину ΔG( реакции) можно подсчитать по следующей формуле:
ΔG(реакции) = ∑ΔGобр(продуктов) – ∑ΔGобр(исходных вещ.) (15)
Проведите самостоятельно расчеты и получите результат: ΔG(реакции) = 129,1 кДж/моль. Положительный знак полученной величины показывает, как мы уже знаем, что при указанных условиях самопроизвольное протекание процесса невозможно.
Рассмотрим теперь случай, когда температура равна 1500оС.
Данные условия не являются стандартными, поэтому рассчитывать значение ΔG(реакции) необходимо в соответствии с формулой (14). Отдельно рассчитайте ΔН (реакции) и ΔS (реакции), используя следствие из законаГесса,:
ΔН (реакции) = – 635,5 – 393,5 + 1207,0 = +178 кДж/моль;
ΔS (реакции) = 39,7 + 213,7 – 88,7 = +164,7 Дж/(моль•К).
Теперь можно посчитать значение искомой величины, не забыв перевести значение температуры в градусы Кельвина по формуле Т К = tºС + 273º; джоули в килоджоули: ΔG (реакции) = +178 – 1773 • 0,165 = –114,0 кДж/моль.
Полученное значение ΔG = –114,0 кДж /моль позволяет сделать вывод о возможности самопроизвольного протекания реакции при температуре 1500оС.
Можно сделать также вывод, что существует такое значение температуры, начиная с которой реакция может протекать самопроизвольно. Определим ее из условия, что ΔG (реакции) = 0, и уравнения (14), подставив значения термодинамических величин и решая уравнение относительно значения температуры:
ΔG = ΔH – TΔS = 0;
ΔH = TΔS;
T = ΔH/ΔS.
Получаем результат: Т = 178 /0,165 =1081 К. Самостоятельно переведите это значение в шкалу Цельсия. После достижения этой температуры процесс разложения карбоната кальция может протекать самопроизвольно.
Таким образом, термодинамика позволяет предсказать принципиальную возможность протекания химических процессов в тех или иных условиях, однако, она ничего не говорит нам о том, насколько быстро будет происходить такое превращение. Термодинамическая возможность осуществления той или иной реакции является необходимым, но недостаточным условием реализации процесса, так как протекание химических реакций всегда связано с преодолением различных энергетических барьеров. Механизмы протекания реакций и закономерности развития их во времени изучаются в другом разделе химии, который называется химической кинетикой.
Date: 2015-09-18; view: 691; Нарушение авторских прав