
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Роль внутренних органов в поддержании кислотно-щелочного резерва
|
|
Чтобы показать комплексное взаимодействие физико-химических и физиологических систем в регулировании рН крови и поддержании кислотно-щелочного равновесия, приводиться простейшая схемароли легких и почек в этом важном для организма процессе.
ЛЕГКИЕ. При воздействии кислот, как было сказано выше, в организме в результате функции бикарбонатной буферной системы накапливается угольная кислота, являясь нестойкой, она разрушается и превращается в свободный углекислый газ СО2 и воду. Углекислый газ физиологически является раздражителем дыхательного центра, накопление СО2 вызывает усиленное дыхание, что приводит к так называемой гипервентиляции и углекислый газ выводится из организма через легкие. Накопление в организме щелочнореагирующих веществ приводит к уменьшению содержания угольной кислоты, стимуляция дыхательного центра уменьшается, что приводит к задержанию углекислого газа в организме и восполнению запасов угольной кислоты, расходуемой при нейтрализации щелочнореагирующих продуктов. Так схематически выглядит механизм регуляции кислотно-щелочного равновесия с помощью легких в норме.
ПОЧКИ. Моча здорового человека имеет слабокислую реакцию. Кислая реакция мочи обусловлена преобладанием в ней однозамещенных фосфорнокислых солей над двузамещенными. В норме рН мочи колеблется от 4,7 до 6,5. Крайние пределы рН мочи при нарушении кислотно-щелочного равновесия колеблются от 4,5 до 8,5. Зависит рН мочи также и от состава пищи. При преобладании в пище мясных продуктов рН мочи сдвигается в кислую сторону, так как в мясе содержится много кислых эквивалентов - соединений серы и фосфора, которые выделяются с мочой в виде сульфатов и фосфатов. При преобладании в моче растительных продуктов рН мочи сдвигается в сторону более высоких значений, что связано с повышенным содержанием в растительной пище солей органических кислот, анионы которых окисляются в тканях, а щелочные эквиваленты выделяются с мочой.
Для характеристики активной реакции мочи пользуются величиной буферной емкости мочи в единицах титрационной кислотности или щелочности. Титрационной_ кислотностью называется количество 0,1н раствора NaOH, необходимого для титрования по фенолфталеину суточного количества мочи. Для здорового человека эта величина составляет 200-400 мл. Можно буферную емкость выражать в г-экв. сильной кислоты или сильного основания, которые необходимо добавить к 1л мочи, чтобы сместить рН на единицу. Для здорового человека в пересчете на суточное количество мочи эта величина равна 20-40 мг-экв.
Полный механизм действия почек изучается студентами на старших курсах, здесь же рассматриваются только некоторые физико-химические аспекты этого вопроса. Поступивший в почки углекислый газ под воздействием фермента - карбоангидразы - превращается в угольную кислоту:
СО2 + Н2О фермент Н2СО3 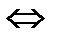 Н + + НСО3 -
Н + + НСО3 -
Возникающие по этой же схеме ионы водорода вступают во взаимодействие с компонентом (гидрофосфат-ионом), работающей в почках фосфатной буферной системы:
НРО4-2 + Н + 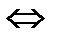 Н2РО4-1
Н2РО4-1
И в виде однозамещенного фосфата натрия удаляются смочой из организма. Моча при этом становится заметно кислой.
В случаях,когда реакция сдвигается в щелочную сторону, работает одновременно бикарбонатная и фосфатная буферные системы:
ОН- + Н2РО4- 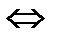 НРО4-2 +Н2О
НРО4-2 +Н2О
ОН- + Н2СО3 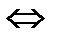 НСО3- + Н2О
НСО3- + Н2О
В результате чего происходит выделение с мочой значительных количеств бикарбонатов (NаНСО3) и гидрофосфатов (Na2HPО4) Моча в этом случае обладает щелочными свойствами и имеет повешенное значение рН.
При сильно выраженных ацидозах, когда буферные системы не обеспечивают нейтрализацию повышенных концентраций ионов водорода, в действие вступает физиологическая функция почек. В почках начинается выработка дополнительного основания, а именно аммиака, который выступает в роли нейтрализующего агента кислых продуктов, накапливающихся в организме. В этом случае в моче обнаруживается повышенная концентрация аммонийных солей.
Несомненно, что в поддержании кислотно-щелочного равновесия, кроме легких и
почек, большую роль играют такие органы, как печень, желудочно-кишечный тракт, и др. В процессе обмена веществ образуются большие количества кислых продуктов. Так в организме человека в спокойном состоянии ежесуточно образуется 20-30л 1н сильной кислоты.
Кроме рассмотренных буферных систем, в сохранениипостоянства реакции среды организма участвует белковая и гемоглобиновая буферные системы
Белковая буферная система состоит из протеина(Pt) и его соли, образованной сильным основанием.Компоненты этой системы могут быть выражены как PtСООН - слабодиссоциированная белок-кислота и ее соль PtCOONa:
PtCOOH 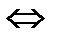 PtCOO - + Н +
PtCOO - + Н +
PtСOОNa 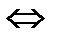 PtCOO - +Nа +
PtCOO - +Nа +
При увеличении концентрации ионов водорода соль белка будет реагировать с кислотами, образуя слабодиссоциируемую белок-кислоту и нейтральную соль.
PtCOONa + HCl 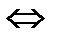 = PtCOOН + NaСl
= PtCOOН + NaСl
При взаимодействии же со щелочами в реакцию вступает белок-кислота и вместо сильного основания образуется слабоосновная соль
PtCOOН+ NaОН 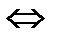 PtCOONa + H2O
PtCOONa + H2O
Таким образом, белковый буфер действует аналогично буферным смесям, рассмотренным ранее.
Однако, белок обладает также свойством амфотерности, так как в состав молекул белка входят некоторые кислые и основные группировки. Поэтому даже отдельная белковая молекула проявляет буферное действие, связывая кислоты и щелочи с образованием солей:
| COO- | COOH | |||
| Pt | + HCl 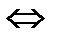 Pt Pt
| +Cl- | ||
| NH 3+ | NH 3+ |
Т.е. при добавлении сильной кислоты образуется слабокислая соль белка. При добавлении щелочи образуется слабоосновная соль по уравнению:
| COO- | COO- | |||
| Pt | + NaОН 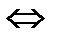 Pt Pt
| + Na+ | ||
| NH 3+ | NH 3ОН |
Благодаря белкам все клетки и ткани организма обладают определенным буферным действием. В связи с этим попадающее, например, на кожу человека небольшое количество кислоты или щелочи довольно быстро оказываются нейтрализованными.
Буферные свойства гемоглобина по своему механизму действия идентичны белковым буферным системам: кислые продукты обмена веществ взаимодействуют с калиевой солью гемоглобина с образованием эквивалентного количества их калиевых солей и свободного гемоглобина, обладающего свойствами слабой органической кислоты.
Кроме того, система оксигемоглобин - гемоглобин участвует еще в одном своеобразном механизме поддержания постоянства рН крови. Как известно, венозная кровь содержит большие количества углекислоты в виде бикарбонатов, а также CO2, связанный с гемоглобином. Через легкие углекислота выделяется в воздух; однако сдвига рН крови в щелочную сторону не происходит, так как образующийся оксигемоглобин является более сильной кислотой, чем гемоглобин. В тканях, в артериальной крови под влиянием низкого парциального давления кислорода оксигемоглобин диссоциирует и кислород диффундирует в ткани. Образующийся при этом гемоглобин, однако, не обуславливает изменение рН крови в щелочную сторону, так как в кровь из тканей поступает углекислота.
Date: 2015-09-17; view: 474; Нарушение авторских прав