
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Повышение температуры кипения растворов
|
|
Кипение представляет собой фазовый переход, при котором происходит превращение жидкости в пар. Температурой кипения жидкости называют ту температуру, при которой давление насыщенного пара над данной жидкостью равна внешнему. При этой температуре и соответствующем ей давлении насыщенного пара устанавливается равновесие между жидкой и газообразной фазами: скорость испарения равна скорости обратного процесса – конденсации и обе эти фазы могут сосуществовать в течение длительного времени.
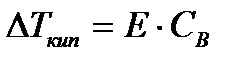 , где
, где
Е – коэффициент пропорциональности, численно равный повышению температуры кипения раствора, содержащего 1 моль растворенного вещества в 1000г растворителя, при условии, что раствор этой концентрации обладает свойствами идеального. Такое повышение температуры кипения называется молярным или эбуллиоскопической постоянной.
Величина Е зависит только от свойств растворителя и может быть найдена либо опытным путем, либо рассчитана по термодинамическому соотношению
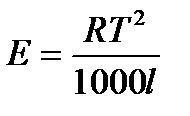 , где
, где
Т – температура кипения чистого растворителя по аб. шкале
l – удельная теплота испарения растворителя
R – универсальная газовая постоянная
Св – концентрация раствора, выражаемая обычно в молях растворенного вещества на 1000 г растворителя.
Если Мв – молярная масса растворенного вещества, mв – его масса (в г), а mА – масса растворителя в граммах, то Св будет определяться следующим соотношением
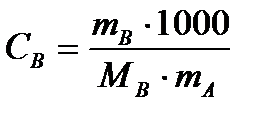
Рассмотрим зависимость давления пара растворителя над чистым растворителем (0А) и над разбавленными растворами разной концентрации нелетучего вещества (ВС и ДЕ) от температуры (рис.1)
P 101,3 кПа А С Е
0 С'
B Е''
D Ткип0 Т’кип T”кип
Температуры, при которых изобара, равная атмосферному давлению (101,3 кПа), пересечет кривые 0А, ВС и ДЕ, будут температурами кипения соответствующих жидкостей при этом давлении. Для растворов эти температуры (Т’кип и T”кип) являются более высокими, чем для чистого растворителя (Ткип0) и разность между ними
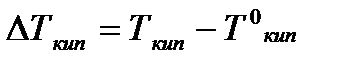
будет тем большей, чем выше концентрация раствора. Для бесконечно разбавленных растворов бесконечно малые участки кривых CC’, ЕЕ’ можно считать прямолинейным. Тогда из подобия треугольников АСС’, АЕЕ’ вытекает, что повышение температуры кипения пропорционально понижению давления насыщенного пара и, следовательно, повышение температуры кипения пропорционально концентрации.
Определив опытным путем повышение температуры кипения раствора, можно вычислить молярную массу вещества
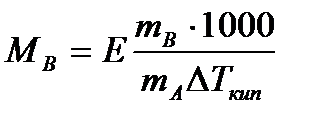
Этот метод определения молекулярных масс носит название эбуллиоскопического.
Date: 2015-09-17; view: 622; Нарушение авторских прав