
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторная работа №9
|
|
Определение постоянной Ридберга и массы электрона.
Цель работы: исследование серии Гальмера и видимой части спектра водорода.
Оборудование: УМ-2, ртутная лампа, водородная лампа.
Теория. Опытом Резерфорда было установлено, что атом любого химического элемента состоит из положительно заряженного ядра, вокруг которого расположены отрицательно заряженные электроны, так что в целом атом нейтрален. Ядро, в котором рассредоточена почти вся масса, занимает ничтожно малую часть его объема. Диаметр ядра порядка 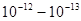 см при размерах атома порядка
см при размерах атома порядка 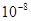 см. Электроны вращаются вокруг ядра в первом приближении по круговым орбитам.
см. Электроны вращаются вокруг ядра в первом приближении по круговым орбитам.
Рассмотрим атом водорода и сходные с ним ионы (водородоподобные атомы), т.е. предположим, что атомная система, состоящая из ядра с зарядом 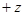 и одного -электрона с зарядом
и одного -электрона с зарядом 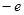 (
(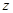 - порядковый номер элемента в таблице Менделеева). Кулоновская сила
- порядковый номер элемента в таблице Менделеева). Кулоновская сила 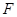 , взаимодействуя между зарядом электрона, играет роль центростремительной силы, следовательно:
, взаимодействуя между зарядом электрона, играет роль центростремительной силы, следовательно: 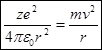 (1),
(1),  Ф/м
Ф/м
Где 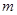 - масса электрона,
- масса электрона,  - радиус орбиты.
- радиус орбиты.
Электроны, находящиеся в электрическом поле ядра, обладают потенциальной энергией: 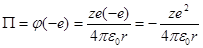
Где 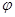 - потенциал в месте нахождения электрона. Полная энергия электрона равна сумме потенциальной и кинетической энергий:
- потенциал в месте нахождения электрона. Полная энергия электрона равна сумме потенциальной и кинетической энергий: 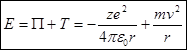 (2)
(2)
Исключая из формулы (1), подставив в (2), получим: 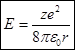 (3)
(3)
Согласно электромагнитной теории, вращающийся по орбите электрон возбуждает вокруг себя переменное поле, распространяющееся в пространстве со скоростью света. Это означает, что вращение электрона должно вызывать непрерывное излучение, на которое электрон затрачивает часть своей энергии. Т.о., согласно классической теории, энергия электрона все время уменьшается.
Из (3) следует, что меньшему значению энергии (с учетом знака) соответствует меньший радиус. В результате электрон должен упасть на ядро. В действительности, атом является устойчивой системой. Из (1) следует, что с уменьшением радиуса орбиты скорость движения электрона возрастает, т.е. период уменьшается. Это должно привести к непрерывному увеличению частоты излучаемых электромагнитных волн и атом должен излучать сплошной спектр. Выход из этого положения был предложен Бором. Основываясь на теории-гипотезе Планка о квантовом характере излучения и поглощения света. Бор сформулировал законы движения электрона в виде постулатов, которые дали объяснения экспериментальным фактам.
- Электрон в атоме вращается только по строго определенным стационарным орбитам, радиус которых определяется условием:

Где 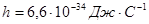 - постоянная Планка,
- постоянная Планка, 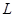 - момент импульса электрона,
- момент импульса электрона, 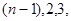 … - квантовое число, определяющее принадлежность электрона той или иной орбите. Все прочие объекты являются запрещенными. Т.о. Бор постулировал, что энергия электрона в атоме может принимать лишь строго определенное значение.
… - квантовое число, определяющее принадлежность электрона той или иной орбите. Все прочие объекты являются запрещенными. Т.о. Бор постулировал, что энергия электрона в атоме может принимать лишь строго определенное значение.
- Вращаясь по стационарным орбитам, электрон не излучает.
- Излучение происходит лишь при переходе электрона из стационарного состояния с большим значением энергии
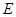 в другое стационарное состояние с меньшим значением энергии
в другое стационарное состояние с меньшим значением энергии 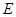 . При этом условии излучается квант света, частота которого определяется из условия:
. При этом условии излучается квант света, частота которого определяется из условия: 
Где 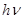 - энергия излучаемого кванта.
- энергия излучаемого кванта.
Отсюда следует, что излучение происходит при переходе электрона с внешних орбит на внутренние. Если возбужденный электрон переходит внутренних орбит на внешние, то происходит поглощение энергии. Опираясь на постулат Бора и соотношение (1) получается выражение для радиуса орбит электрона: 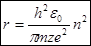 (4)
(4)
С учетом этого полная энергия электрона в атоме принимает вид: 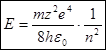 (5)
(5)
Атомная система, состоящая из ядра электрона, переходя из состояния характеризуемого квантовым числом, в состояние с квантовым числом, испускает, по третьему постулату Бора, линии с частотами: 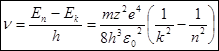 (6)
(6)
Величину называют постоянной Ридберга: 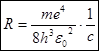 (7)
(7)
Таким образом: 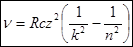 (8)
(8)
Вычисленное по (7) значение постоянной Ридберга с большой точностью совпадает с экспериментальным. В разряженных газах или парах металлов расстояние между отдельными атомами незначительно. Поэтому спектры таких газов состоят из отдельных спектральных линий различных частот, также подчиняющихся уравнению (8). Т.к. (8) можно переписать в виде: 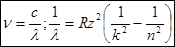 (9)
(9)
Формула (9) является одной из наиболее точных формул физики. Из нее следует, что линии спектра могут быть объединены в серии. Серией называется совокупность линий, описываемых этой формулой, если 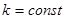 , т.е. серии возникают при переходе и выше электрона лежащих орбит с данным квантовым числом
, т.е. серии возникают при переходе и выше электрона лежащих орбит с данным квантовым числом 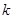 .
.
Для водорода, 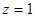 , основными сериями является серия Лаймера
, основными сериями является серия Лаймера 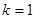 ,
, 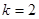 -серия Бальмера,
-серия Бальмера, 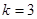 - серия Пашена,
- серия Пашена, 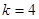 - серия Беккета,
- серия Беккета, 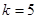 -серия Пфунта. Некоторые серии водорода, а в частности Бальмера, были получены экспериментально до создания теории Бора. Видимая часть линейчатого спектра (серия Бальмера) состоит из ряда линий, наиболее яркими из которых являются следующие четыре: красная (П-3), голубая (П-4), фиолетовая (П-5), фиолетовая (П-6).
-серия Пфунта. Некоторые серии водорода, а в частности Бальмера, были получены экспериментально до создания теории Бора. Видимая часть линейчатого спектра (серия Бальмера) состоит из ряда линий, наиболее яркими из которых являются следующие четыре: красная (П-3), голубая (П-4), фиолетовая (П-5), фиолетовая (П-6).
Несмотря на удачное объяснение спектральных закономерностей водородоподобных атомов, теория Бора обладает рядом недостатков. В частности она не может объяснить излучения более сложных атомов и различную интенсивность спектральных линий. Эти трудности были преодолены квантовой теорией.
Date: 2015-09-05; view: 606; Нарушение авторских прав