
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 11. Коллигативные свойства растворов
|
|
11.1. Растворимость твердого вещества в идеальном растворе.
Растворимость твердого вещества в данном растворе измеряется концентрацией его насыщенного раствора при данной температуре и давлении. Насыщенный раствор – это раствор, находящийся в равновесии с кристаллами твердого вещества, следовательно в насыщенном растворе химические потенциалы растворенного вещества в жидкой и твердой фазах одинаковы:
μ2 (раствор) = μ2 (кристаллы)
Если при растворении твердого вещества образуется идеальный раствор, то химический потенциал этого вещества в насыщенном растворе будет:
μ2 (раствор) = μ02 (ж) + RT ln x2нас,
где μ02 (ж) – химический потенциал чистого растворенного вещества в жидком состоянии. Тогда, очевидно,
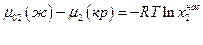
Но 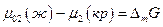 изменение энергии Гиббса при плавлении 1 моля растворенного вещества при температуре раствора. По уравнению Гиббса-Гельмгольца
изменение энергии Гиббса при плавлении 1 моля растворенного вещества при температуре раствора. По уравнению Гиббса-Гельмгольца
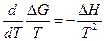
где Δ G иΔ Н относятся к одному и тому же процессу, поэтому получаем при постоянном давлении
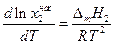
В полученном уравнении отсутствуют величины, характеризующие индивидуальные свойства растворителя. Следовательно, идеальная растворимость твердых тел не зависит от природы растворителя. А поскольку 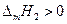 , то
, то 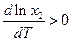 , т.е. с ростом температуры идеальная растворимость увеличивается.
, т.е. с ростом температуры идеальная растворимость увеличивается.
Разделим переменные и возьмем интеграл от 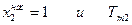 - температуры плавления чистого твердого вещества до
- температуры плавления чистого твердого вещества до  -состава насыщенного раствора при температуре Т
-состава насыщенного раствора при температуре Т
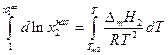
Теплоемкости жидкого и твердого вещества сравнительно мало отличаются друг от друга, поэтому можно предположить, что в интервале от Т до Тт2 ΔтН2 =const и после взятия интегралов имеем:
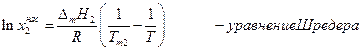
Поскольку Тт2 > T, то 1/Tm2 < 1 / T, следовательно, чем выше температура плавления вещества, тем меньше его растворимость. Заметим, что уравнение Шредера может оказаться весьма полезным для оценки растворимости твердых органических веществ, особенно при разработке процессов перекристаллизации, или для расчета необходимого количества растворителя.
Влияние давления на идеальную растворимость можно оценить следующим образом. Так как
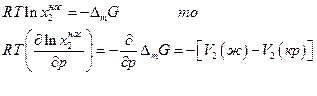
где V2(ж) – мольный объем растворенного вещества в расплавленном переохлажденном состоянии при температуре раствора, V2(кр) – мольный объем твердого растворенного вещества. Для большинства веществ V2(ж) >, V2(кр), поэтому с увеличением давления при постоянной температуре идеальная растворимость уменьшается.
11.2. Понижение температуры замерзания растворов. Криоскопия.
Будем понимать под температурой кристаллизации раствора ту температуру, при которой кристаллы растворителя находятся в равновесии с раствором, т.е. раствор при этой температуре становится насыщенным относительно растворителя. Из условий равновесия имеем:
μ1 (кр) = μ1 (р-р)
Если раствор достаточно разбавлен, то давление пара растворителя подчиняется закону Рауля р1 =р01 ·х1, поэтому
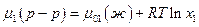
и, повторив выкладки предыдущего параграфа, получим
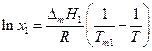
где Тт1 –температура кристаллизации чистого растворителя, Т – температура кристаллизации раствора, имеющего концентрацию растворителя х1. Так как
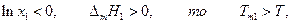 т.е. температура замерзания чистого растворителя выше, чем температура замерзания раствора, причем последняя определяется только его концентрацией х1 и свойствами растворителя Δ тН1 и Тт1 .
т.е. температура замерзания чистого растворителя выше, чем температура замерзания раствора, причем последняя определяется только его концентрацией х1 и свойствами растворителя Δ тН1 и Тт1 .
Преобразуем полученное уравнение:
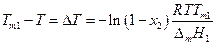
Если х2 мало (раствор разбавлен), то 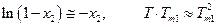
и 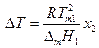
Поскольку в разбавленном растворе моляльность т2 и мольная доля х2 связаны соотношением 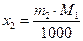
где М1 - мольная масса растворителя, то
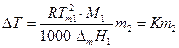
Величина К называется криоскопической константой растворителя.
С помощью измерений Δ Т для данного растворителя с известной К можно определить мольную массу растворенного вещества:
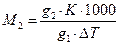
где g1 и g2 навески растворителя и растворенного вещества в граммах.
Криоскопия – один из способов определения мольных масс или чистоты вещества. Надежные результаты получаются в растворителях с высокими значениями криоскопических постоянных при условии, что при растворении не происходит диссоциации или ассоциации молекул растворенного вещества. Диссоциация Растворенного вещества приводит к увеличению его числа частиц (ионов). Поэтому для растворов электролитов:
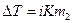
где i – изотонический коэфициент Вант-Гоффе, показывающий во сколько раз увеличилось число частиц в растворе вследствие диссоциации:
i = 1 + α (n-1)
где α –степень диссоциации, п –число ионов, на которые распадается молекула.
| Растворитель | К |
| Вода | 1,86 |
| Бензол | 5,12 |
| Циклогексан | 20,0 |
| Сероуглерод | 3,8 |
| Камфора |
Если α = 1, то i = n. Однако i практически всегда меньше n, так как ионы в растворах не свободны, а связаны силами электростатического взаимодействия. Измерив Δ Т раствора известной моляльности можно определить изотонический коэффициент, а следовательно, степень диссоциации, что особенно пригодно для слабых электролитов. Приведем еще таблицу замерзания водноэтанольных растворов
| m | |||||||
| t 0C | -3,6 | -7,92 | -12,3 | -22 | -30 | -36 | -42 |
11.3. Температура кипения растворов нелетучих веществ. Эбулиоскопия.
Раствор, как и любая жидкость, кипит, когда давление насыщенного пара станет равным внешнему давлению. Если растворенное вещество нелетуче, то пар будет содержать только растворитель и по закону Рауля давление пара растворителя над раствором всегда меньше, чем над чистым растворителем при той же температуре, поэтому раствор должен кипеть при более высокой температуре.
Если раствор достаточно разбавлен и соблюдается закон Рауля, то в точке кипения раствора
P (внешнее) = р1 =р01·х1
Date: 2015-09-18; view: 461; Нарушение авторских прав