
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Цветность химических соединений
|
|
С эффектами поляризации связана цветность химических соединений как в твердых фазах, так и в растворах. Как известно, окраска химических соединений определяется долей непоглощенных лучей (квантов энергии) видимой части спектра. При полном поглощении всех лучей вещество имеет черную окраску, а при отсутствии поглощении – белую окраску. Кванты энергии, соответствующие частотам видимой части спектра, обладают сравнительно большой величиной. Поэтому способность к возбуждению (переходу на более отдаленные уровни энергии) при поглощении этих квантов энергии приобретают именно те электроны, которые теряют прочную связь с ядром. Подобная неустойчивость структуры внешнего квантового слоя ионизированных атомов возникает за счет эффектов поляризации.
Следовательно, все факторы, изменяющие поляризуемость и поляризующее действие ионизированных атомов в химических соединениях, должны оказывать влияние на цветность этих веществ. Действительно, между цветностью химических соединений и степенью устойчивости структуры внешних квантовых слоев ионизированных элементов, входящих в их состав, наблюдается определенный параллелизм.
Растворимость кристаллических веществ зависит также от эффектов поляризации. Двусторонняя поляризация ионизированных атомов в химическом соединении приводит к уменьшению постоянного дипольного момента ковалентной связи, полярность связи уменьшается. Обычно при этом уменьшается и растворимость веществ.
Односторонняя поляризация одного из ионизированных атомов в химическом соединении повышает полярность ковалентной связи, вплоть до перехода ее в ионную связь. Соответственно повышается растворимость вещества. Таким образом, изменение растворимости однотипных солей, при замене в них катионов ли анионов, позволяет ориентировочно судить о степени полярности связей между атомами элементов.
Поляризуемость и поляризующее действие весьма характерны для реальных и условных катионов d-элементов (переходных металлов), особенно для катионов, имеющих высокое значение положительного окислительного числа (Cr 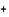
 , Mn
, Mn 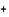
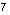 и др.).
и др.).
Влияние эффектов поляризации на цветность химических соединений можно проиллюстрировать рядом примеров. Чем меньше радиус и больше заряд условных катионов в составе оксидов, образованных s- и d-электронами IV периода, при одинаковой электронной структуре их внешнего квантового соя, тем больше вероятность интенсивной окраски данного соединения.
Цветность оксидов элементов IV периода закономерно увеличивается в ряду:
K2O CaO TiO2 V2O5 Cr2O3 Mn2O7
бесцветный оранжевый темно-красный черно-зеленый
Реальные и условные анионы в составе химических соединений обладают высокой поляризуемостью, поскольку в структуре внешних квантовых слоев этих частиц имеются добавочные электроны. Поляризуемость возрастает с увеличением отрицательного заряда и радиуса анионов (см таблицу 5.1):
I  > Br
> Br  > Cl,
> Cl,
S²  >O²
>O²  >OH
>OH  .
.
Поэтому окрашенность однотипных химических соединений, как правило, усиливается при увеличении радиуса и заряда входящих в его состав изоэлектронных анионов. Иодиды более окрашены, чем бромиды, хлориды и фториды. Сульфиды имеют более интенсивную окраску, чем оксиды, а оксиды – более интенсивную, чем гидроксиды.
Цветность солей в твердой фазе и в растворах зависит часто от взаимной поляризации ионов и полярных молекул растворителя. Так, например, безводная соль CuSO4 бесцветна, а водный раствор CuSO4. окрашен в голубой цвет за счет образования комплексного иона [Cu(H2O)4] 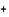 ². Еще интенсивнее окраска комплексного иона [Cu(NH3)4]
². Еще интенсивнее окраска комплексного иона [Cu(NH3)4] 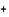 ² образующегося при добавлении концентрированного раствора аммиака в раствор CuSO4. Безводная соль имеет синюю окраску, а по мере увлажнения приобретает розовый цвет, присущий комплексному иону [Co(H2O)6]
² образующегося при добавлении концентрированного раствора аммиака в раствор CuSO4. Безводная соль имеет синюю окраску, а по мере увлажнения приобретает розовый цвет, присущий комплексному иону [Co(H2O)6] 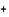 ² и т.д.
² и т.д.
Окраска многих комплексных соединений металлов семейства d обусловлена взаимной поляризацией компексообразователя (катиона металла) и лигандов (молекул H2O, NH3, ионов OH  , CN
, CN  и др.). Нагревание веществ способствует уменьшению устойчивости электронной структуры внешнего квантового слоя атомов и повышает взаимную поляризацию ионизированных атомов. Поэтому нагревание может способствовать повышению цветности соединений. Так, бесцветная окись цинка ZnO желтеет при нагревании. Желтая окраска комплексной соли Ag[HgI4] при нагревании до 38º C переходит в ярко-оранжевую.
и др.). Нагревание веществ способствует уменьшению устойчивости электронной структуры внешнего квантового слоя атомов и повышает взаимную поляризацию ионизированных атомов. Поэтому нагревание может способствовать повышению цветности соединений. Так, бесцветная окись цинка ZnO желтеет при нагревании. Желтая окраска комплексной соли Ag[HgI4] при нагревании до 38º C переходит в ярко-оранжевую.
Исследование поляризационных эффектов осуществляется на современном уровне науки путем сложных физических экспериментов. Однако, пользуясь зависимостью между цветностью химических соединений, а также их растворимостью и поляризационными эффектами, можно ориентировочно судить и о поляризуемости и поляризующем действии условных или реальных ионов в составе химических соединений.
Date: 2015-09-03; view: 458; Нарушение авторских прав