
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Поляризация
|
|
Поляризация – взаимное смещение ядра и электронной оболочки внешнего электронного слоя под действием электрического поля соседнего иона.
Поляризуемость – степень деформации иона при поляризации.
Поляризующая способность – способность иона оказывать поляризующее воздействие.
В химических соединениях с полярной ковалентной и ионной связью наблюдаются явления взаимной поляризации катионов и анионов (двусторонняя поляризация) или преимущественной поляризации одного из ионизированных атомов (односторонняя поляризация). Поляризационные эффекты зависят от электронной структуры ионизированных атомов, от их радиуса и эффективного или реального заряда. Различают поляризуемость и поляризующие действия условных и реальных катионов и анионов (табл.2.1)
Таблица 2.1
| Катионы | Анионы |
| 1. Поляризуемость катионов растет при уменьшении (+о.ч.), с увеличением радиуса катиона и при переходе структуры внешнего квантово слоя от 8-электронной к 18-электронной. | 1. Поляризуемость анионов выше, чем катионов, и растет при повышении (-о.ч.) и с увеличением радиуса аниона. |
| 2. Поляризующее действие катионов растет при увеличении (+о.ч.), с уменьшением радиуса катиона и при переходе структуры внешнего квантово слоя от 8-электронной к 18-электронной. | 2. Поляризующее действие анионов меньше, чем катионов, и снижается с увеличением радиуса аниона. |
Следует учитывать отличие электронной структуры реальных и условных катионов и анионов от структуры соответствующих атомов элементов.
Электронные структуры внешнего квантового слоя катионов различных s – p – d – f элементов изменяются в соответствии со степенью окисления атомов (+ о.ч.)
Образование катионов s-элементов сопровождается потерей s-электронов с внешнего квантового слоя, если окислительное число (+о.ч.) не достигает максимального значения, определяемого номером группы в периодической системе Д.И. Менделеева. При удалении всех валентных s- и p-электронов роль внешнего квантового слоя начинает играть предвнешний квантовый слой.
Для катионов d- и f-элементов характерна потеря двух (одного) s-электронов с внешнего квантового слоя. В зависимости от значения (+о.ч.) в процессе ионизации d-элементы теряют также d-электроны с предвнешнего квантового слоя, а f-элементы способны отдавать, кроме того, f-электроны с предвнешнего квантового слоя.
Таким образом, во всех случаях, когда внешним квантовым слоем у катионов s – p – d – f-элементов становится их предвнешний квантовый слой, электронная структура его может изменяться в пределах от 8-электронной (s p) до 18-электронной (s p d). Исключение составляют катионы s и p-элементов второго периода, у которых после потери всех валентных электронов предвнешний квантовый слой имей 2-электронную структуру.
Для иллюстрации указанных закономерностей сопоставим электронные формулы атомов и катионов различных химических элементов (табл.2.2).
Таблица 2.2
Атом
Li 1s² / 2s¹
Al 1s² / 2s²2p 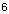 / 3s²3p¹
Sn 1s² / 2s²2p / 3s²3p¹
Sn 1s² / 2s²2p  / 3s²3p / 3s²3p  3d¹º
Ti 1s² / 2s²2p 3d¹º
Ti 1s² / 2s²2p  / 3s²3p / 3s²3p  3d¹º/4s²
Fe 1s² / 2s²2p 3d¹º/4s²
Fe 1s² / 2s²2p  / 3s²3p / 3s²3p  3d 3d  / 4s²
Zn 1s² / 2s²2p / 4s²
Zn 1s² / 2s²2p  / 3s²3p / 3s²3p  3d¹º / 4s² 3d¹º / 4s²
| Катион
Li 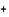 ¹ 1s²
Al ¹ 1s²
Al 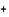 ³ 1s² / 2s²2p ³ 1s² / 2s²2p  Sn
Sn 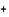 ² 1s² / 2s²2p ² 1s² / 2s²2p  / 3s²3p / 3s²3p  3d¹º /
4s ²4p 3d¹º /
4s ²4p  4d¹º / 5s²
Sn 4d¹º / 5s²
Sn 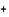  1s² / 2s²2p 1s² / 2s²2p  / 3s²3p / 3s²3p  3d¹º /
4s ²4p 3d¹º /
4s ²4p  4d¹º
Ti 4d¹º
Ti 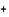 ² 1s² / 2s²2p ² 1s² / 2s²2p  / 3s²3p / 3s²3p  3d ²
Ti 3d ²
Ti 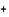 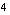 1s² / 2s²2p 1s² / 2s²2p  / 3s²3p / 3s²3p  Fe
Fe 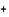 ² 1s² / 2s²2p ² 1s² / 2s²2p  / 3s²3p / 3s²3p  3d 3d  Zn
Zn 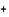 ² 1s² / 2s²2p ² 1s² / 2s²2p  / 3s²3p / 3s²3p  3d¹º 3d¹º
|
Катионы, обладающие одинаковой электронной структурой, называют изоэлектронными.
Очевидно, что радиусы катионов всегда меньше радиусов соответствующих атомов за счет потери электронов и уменьшаются по мере увеличения окислительного числа (+о.ч.) (см таблицу 5.1).
Для элементарных анионов характерны электронные структуры внешнего квантового слоя типа 8-электронной оболочки, поскольку при формировании анионов атомы элементов неметаллов принимают электроны, обычно дополняя структуру внешнего квантового слоя до 8-электронной.
Сопоставим электронные структуры некоторых атомов элементов неметаллов и соответствующих анионов (табл.2.3).
Таблица 2.3
Атом
N 1s² / 2s²2p³
S 1s² / 2s²2p  / 3s²3p / 3s²3p 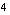 Cl 1s² / 2s²2p
Cl 1s² / 2s²2p  / 3s²3p / 3s²3p 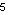
| Анион
N  ³ 1s² / 2s²2p³2p ³ 1s² / 2s²2p³2p  S
S  ² 1s² / 2s²2p ² 1s² / 2s²2p  / 3s²3p / 3s²3p  Cl
Cl  ¹ 1s² / 2s²2p ¹ 1s² / 2s²2p  / 3s²3p / 3s²3p 
|
Анионы, обладающие одинаковой электронной структурой, называют изоэлектронными.
Очевидно, что радиусы анионов больше радиусов соответствующих атомов элементов за счет присоединения электронов (см. таблицу 5.1).
Date: 2015-09-03; view: 694; Нарушение авторских прав