
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тема: халькогени
|
|
| R (A) | I1, эВ | Еа, эВ | Ступені окислення | |
| O | 0.60 | 13.6 | 1.467 | -1, -2 |
| S | 0.90 | 10.4 | 2.077 | -2, 0, +2,+4,+6 |
| Se | 1.16 | 9.75 | 2.02 | -“- |
| Te | 1.35 | 9.1 | 2.0 | -“- |
| Po | 1.64 | 8.43 | 0, +2, +4 |
До елементів VІ А групи належать Оксиген, Сульфур, селен, телур та радіоактивний полоній. Групова назва цих елементів - халькогени, тобто "що народжують мідні руди", обумовлено тим, що у природі вони зустрічаються частіше у вигляді сполук Купруму (сульфідів, оксидів, селенідів). Атоми халькогенів мають електронну конфігурацію s2p4 з двома неспареними р-електронами.
При переході від Оксигену до полонію розмір атомів та їх можливі координаційні числа зростають, а енергія іонізації (Еіон) та електронегативність зменшуються. В сполуках Сульфуру, селену, телуру з Оксигеном і галогенами реалізуються ступені окислення +6, +4 і +2. З більшістю інших елементів вони утворюють халькогеніди, де находяться в ступені окислення -2. Стійкість сполук з вищим ступенем окислення зменшується від телуру до полонію. В сполуках з негативними ступенями окислення від Сульфуру до телуру зростають відновні, а в сполуках з позитивними ступенями окислення – окисні властивості.
Одне з характерних властивостей атомів халькогенів - їх здатність зв’язуватися один з одним у кільця та ланцюги. Це явище називають катенацією, яка яскраво спостерігається у Сульфуру, селену и телуру. Для них відомі багаточислені лінійні та циклічні молекулярні форми, утворені ланцюгами. З катенацією зв’язані алотропія і поліморфізм простих речовин.
 Відомо декілька поліморфних модифікацій Сульфуру: ромбічна (<960С), моноклінна (96-1190С), пластична. Остання нестійка і при зберіганні поступово переходить до ромбічної модифікації. Алотропія Сульфуру обумовлена не різним числом атомів в молекулі, як у Оксигену, а різною будовою восьмиатомних молекул. По мірі нагрівання кільця розриваються і утворюються молекули з відкритим ланцюгом атомів.
Відомо декілька поліморфних модифікацій Сульфуру: ромбічна (<960С), моноклінна (96-1190С), пластична. Остання нестійка і при зберіганні поступово переходить до ромбічної модифікації. Алотропія Сульфуру обумовлена не різним числом атомів в молекулі, як у Оксигену, а різною будовою восьмиатомних молекул. По мірі нагрівання кільця розриваються і утворюються молекули з відкритим ланцюгом атомів.
Стабільність водневих сполук халькогенів зменшується в групі. Сірководень можливо отримати як і решту халькогеноводнів за реакцією: FeЭ + H2SO4 ® FeSO4 + Н2Э
Халькогеноводні – слабкі кислоти, сила яких зростає у групі. Вони виявляють відновні властивості. Сірководень горить на повітрі:
H2S + O2® H2O + SO2
Сірководень утворює кислі та середні солі. Більшість сульфідів нерозчинні у воді за виключенням сульфідів лужних металів та амонію.
Сульфур реагує з флуором: S + F2 ® SF6; (SF4, S2F10). З Хлором утворюються лише низькі хлориди і оксихлориди: S2Cl2, SCl2. Селен та телур утворюють ЭГ4 - галогенангідриди, які з солями лужних металів утворюють комплекси K[SeF5], K2[SeCl6], Cs2[TeI6].
Оксид Сульфуру (ІV) отримують в лабораторіях за реакцією:
Na2SO3 + 2HCl = SO2 + 2NaCl + H2O
При розчиненні утворює сульфітну кислоту (Н2SO3). Вона нестійка, існує лише у водних розчинах, утворює солі – гідросільфіти і сульфіти. Сірчиста кислота досить активний відновник, який окислюється у розчинах Хлору, перманганату, біхромату калію. В результаті окислення утворюється сульфатна кислота. Проте, при взаємодії з більш активними відновниками виявляє окисні властивості.
Н2SO3 + 2Н2S = 3S + 3H2O
Оксид Сульфуру (VІ) жадібно з’єднуються з водою, розчиняючись утворює сульфатну кислоту (Н2SO4). Пари триоксиду Сульфуру не можуть безпосередньо поглинатися водою в наслідок високого парціального тиску останньої і утворює туман, який не конденсується. Проте, пари SO3 повністю поглинаються концентрованою сірчаною кислотою. Оксид Сульфуру (VІ) та сульфатна кислота сильні окисники. З розведеної кислоти, метали, що стоять в ряду напруг до Гідрогену, витісняють Гідроген. Концентрована сульфатна кислота при нагріванні окислює практично всі метали, відновлюючись до оксиду Сульфуру (ІV), або вільної Сульфуру чи сірководню.
Cu + 2H2SO4 = SO2 + CuSO4 + 2H2O
3Zn +4H2SO4 = S + 3ZnSO4 + 4H2O
4Zn +5H2SO4 = H2S + 4ZnSO4 + 4H2O
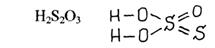 Сульфатна кислота утворює нормальні солі – сульфати та кислі солі – гідросульфати.
Сульфатна кислота утворює нормальні солі – сульфати та кислі солі – гідросульфати.
 При умовному заміщенні в сірчаній кислоті або її солях одного атома Оксигену на атом Сульфуру утворюється відповідно тіосульфатна кислота (H2S2O3) та її солі тіосульфати. Останні можуть бути отримані кип’ятінням розчинів сульфітів з сіркою. За дії сильних окисників (Хлору) тіосульфати окислюються до сульфатної кислоти. Сульфур входить до складу піросульфатної кислоти (H2S2O7), яка утворює солі – піросульфати та надсульфатної кислоти (H2S2O8), яка утворює солі – персульфати. Над сульфатна кислота містить пероксидний ланцюг, що обумовлює її сильні окисні властивості. Солі піросульфатної та надсульфатної кислот також є сильними окисниками.
При умовному заміщенні в сірчаній кислоті або її солях одного атома Оксигену на атом Сульфуру утворюється відповідно тіосульфатна кислота (H2S2O3) та її солі тіосульфати. Останні можуть бути отримані кип’ятінням розчинів сульфітів з сіркою. За дії сильних окисників (Хлору) тіосульфати окислюються до сульфатної кислоти. Сульфур входить до складу піросульфатної кислоти (H2S2O7), яка утворює солі – піросульфати та надсульфатної кислоти (H2S2O8), яка утворює солі – персульфати. Над сульфатна кислота містить пероксидний ланцюг, що обумовлює її сильні окисні властивості. Солі піросульфатної та надсульфатної кислот також є сильними окисниками.
Date: 2015-09-02; view: 1373; Нарушение авторских прав