
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Задача 6. Пусть Х – доля минорного компонента
|
|
Пусть Х – доля минорного компонента. Константа равновесия реакции изомеризации может тогда быть представлена следующим образом:
К = Х:(1-Х) = 0,11. Отсюда Х = 0,099, т.е. доли изомеров составляют 9,9% и 90,1%. Наиболее термодинамически стабилен 2-бромпропан, он будет в избытке.
Одним из удобных способов синтеза является следующий:
CaC2 + 2H2O = HC≡CH + Ca(OH)2
Al4C3 + 12HCl = 3CH4 + 4AlCl3
CH4 + Br2 = CH3Br
HC≡CH + NaNH2 = HC≡CNa + NH3 (вместо NaNH2 можно использовать Na)
HC≡CNa + CH3Br = HC≡CCH3 + NaBr
HC≡CCH3 + H2 = H2C=CHCH3 (реакция идет в присутствии каталитически активного Pd)
H2C=CHCH3 + HBr = H3CCHBrCH3
Однако возможны и другие пути синтеза.
Задания теоретического тура заключительного (городского) этапа
Ой Санкт-Петербургской олимпиады по химии.
Класс
Автор заданий – Бегельдиева С.М.
1. В какой массе воды необходимо растворить 213 г оксида фосфора (V) для получения раствора с массовой долей растворенного вещества 49%? Запишите молекулярную и структурную формулы этого растворенного вещества, назовите его.
2. Атомная масса элемента Х относится к молекулярной массе его бромида как 1: 5. Определите формулу этого соединения. Назовите его. Ответ подтвердите расчетами.
3. Рассчитайте относительную молекулярную массу углекислого газа по системе Берцелиуса, в которой атомная масса кислорода была принята равной 100 единицам.
4. Простое вещество, молекула которого имеет массу 1,18·10–22 г, вступает в реакции с железом, водородом, фосфором и водой. Определите и назовите данное простое вещество. Напишите уравнения упомянутых химических реакций и укажите условия их протекания.
5. Обведите варианты правильного ответа
1.Укажите сумму протонов, нейтронов и электронов для 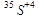 .
.
Варианты ответов: а) 47 б) 35 в) 19 г) 16 д) нет правильного ответа.
2. Какой заряд приобретет атом бария, если он достигнет электронной конфигурации ближайшего инертного газа?
Варианты ответов: а) +1 б) +2 в) -6 г) -2 д) нет правильного ответа.
3. Масса 2,24 л газа (н.у.) равна 2,8 г. Чему равна молекулярная масса газа?
Варианты ответов: а) 14 б) 28 в) 42 г) 5,6 д) нет правильного ответа.
4. Ангидридом какой кислоты можно считать SO2?
Варианты ответов: а) серной б) сернистой в) серноватой г) сероводородной д) нет правильного ответа.
5. Какой газ выделяется при действии соляной кислоты на раствор сульфида цинка?
Варианты ответов: а) аммиак б) сернистый в) сероводород г) выделения газа в этих условиях не происходит д) нет правильного ответа.
6. Какое максимальное количество вещества углекислого газа может поглотить раствор, содержащий 1 моль гидроксида калия?
Варианты ответов: а) 0,5 моль б) 1 моль в) 2 моль г) 22 г д) нет правильного ответа.
7. Укажите состав твердого остатка, который образуется при термическом разложении бертолетовой соли.
Варианты ответов: а) твердый остаток не образуется б) хлорид калия в) оксид алюминия
г) гидроксид калия и оксид алюминия д) нет правильного ответа.
8. В двух одинаковых колбах объемом по 2 литра при одинаковом давлении и температуре находятся соответственно угарный газ и аммиак. Сравните число молекул аммиака и водорода в колбах.Варианты ответов: а) в колбах содержится равное число молекул б) молекул аммиака больше в) молекул водорода больше г) невозможно сравнить число молекул, исходя из представленных данных д) нет правильного ответа.
9. Формула высшего оксида элемента с порядковым номером 32:
Варианты ответов: а) R2O б) R2O3 в) RO2 г) RO3 д) нет правильного ответа.
10. Смесь водорода и кислорода объемом 5 литров взорвали. После конденсации паров воды объем оставшегося газа составил 2 литра, причем в оставшемся газе вспыхивает тлеющая лучинка.
Определите объем водорода в исходной смеси, учитывая, что объемы всех газов измерены при одинаковых условиях.
Варианты ответов: а) 3 л б) 2л в) 1л г) 1,5л д) нет правильного ответа.
6. Определите количество вещества воды, которое приходится на 1 моль соли в 10%-ном растворе сульфата меди (II).
7. Завершите уравнения химических реакций. Назовите продукты этих реакций.
? +? = HF? +? = HF +? H2 + N2 =?
H2 +? = Cu +?? = O3 Ba +? = Ba(OH)2 +?? +? = CaBr2
Na2O +? = Na2SiO3 P + O2 =? (CuOH)2CO3 =? +? +?
Класс
Авторы заданий – Злотников Э.Г. (№№ 1-4, 6-7). Скрипкин М.Ю. (№ 5)
№1
В таблице Вам предложены результаты анализа пяти минералов:
| № минерала | Содержание элемента, % | |||||||||
| H | O | C | Cl | S | Mg | Fe | Ca | K | Cu | |
| 0,58 | 36,99 | 6,94 | - | - | - | - | - | - | 55,49 | |
| - | 52,17 | 13,04 | - | - | 13,05 | - | 21,74 | - | - | |
| 2,42 | 45,07 | - | 14,28 | 12,88 | 9,66 | - | - | 15,69 | - | |
| 4,32 | 34,60 | - | 38,38 | - | 8,65 | - | - | 14,05 | - | |
| - | - | - | - | 34,78 | - | 30,44 | - | - | 34,78 |
По этим данным воспроизведите их формулы в виде химических соединений. Как эти минералы называются? Приведите для каждого минерала по два уравнения химических реакций с его участием.
№2
В соответствии с положением в периодической системе фосфор может образовывать два наиболее характерных оксида. Эти оксиды растворили в воде. На полученные растворы последовательно подействовали избытком растворов: а) щелочи; б) хлорной воды; в) нитрата бария. Полученные в обоих случаях осадки отфильтровали, смешали с песком, углем и прокалили. Напишите уравнения всех указанных в условии задачи реакций.
№3
Предложите формулу для расчета количественного состава водородно-метановой смеси в объемных долях, если анализ проводился следующим образом. Объем А газовой смеси сожгли в избыточном объеме кислорода В. После поглощения углекислого газа и конденсации образовавшейся воды, измерили объем непрореагировавшего кислорода С. Все измерения проводились при одинаковых условиях.
№4
В водный раствор нитрата меди (II) поместили несколько кусочков металлического кальция. Какие химические реакции могут произойти при этом? Напишите уравнения возможных реакций и дайте соответствующие пояснения.
№5
Как известно, нанотехнологии являются одним из наиболее быстро развивающихся направлений науки и техники. При этом все большее внимание уделяется синтезу и исследованию сферических биметаллических “core-shell” наночастиц, т.е., наночастиц, у которых внутреннее ядро состоит из атомов одного, а внешняя оболочка – из атомов другого металла.
А) Что такое наночастица?
Б) Оцените размер наночастицы, ядро которой состоит из 50 атомов золота, а оболочка – из 50 атомов серебра. Для справки: плотность серебра составляет 10,50 г/см3, а плотность золота – 19,32 г/см3.
В) Предложите способ синтеза суспензии, содержащей такие наночастицы, с использованием в качестве исходных веществ тригидрата тетрахлорозолотой кислоты, ляписа, формиата натрия, воды.
№6
В соответствии с правилами техники безопасности химические реагенты надо хранить в плотно закрытых склянках или банках. Какие химические реагенты и почему нельзя хранить в открытых или неплотно закрытых склянках? Дайте мотивированный ответ.
Назовите 5 реагентов, которые нельзя хранить на свету. Приведите примеры несовместимых реагентов. В чем заключается их несовместимость? Ваши ответы подтвердите соответствующими уравнениями реакций.
№7
При горении 16,8 л (н. у.) смеси аммиака и кислорода выделилось 94,95 кДж теплоты, а при горении того же количества смеси с некоторым количеством водорода – 300,0 кДж теплоты. Вычислите состав исходной смеси в объемных долях, если теплоты образования аммиака и воды соответственно равны 46,1 и 241,6 кДж/моль.
Класс
Авторы заданий – Скрипкин М.Ю. (№№ 1, 2, 4), Гусев И.М. (№ 3), Байгозин Д.В. (№ 5), Пошехонов И.С.
(№ 6), Башмаков В.Я. (№ 7)
№1
Как известно, восстановительные свойства металлов коррелируют с их положением в электрохимическом ряду напряжений. Вместе с тем, анализ различных экспериментальных данных позволяет увидеть некоторые противоречия между «теорией» и «практикой». Рассмотрите приведенные ниже случаи и объясните их:
а) Как известно, восстановительные свойства простых веществ возрастают при движении вниз по группе периодической системы. Вместе с тем, в ряду напряжений литий находится левее калия и натрия, калий – левее цезия.
Б) железо находится в ряду напряжений левее меди, однако водный раствор хлорного железа растворяет металлическую медь;
В) медь находится в ряду напряжений правее водорода, однако выделяет водород из водного раствора иодоводорода и из раствора хлороводорода в ацетонитриле (CH3C≡N).
№2
При растворении в воде 3,00 г бесцветного кристаллического вещества А выделилось 4,98 л (н.у.) газа Б с плотностью 89 мг/л и образовался мутный раствор. Через полученный раствор пропустили углекислый газ – при этом выпал бесцветный студенистый осадок В, растворимый как в кислотах, так и в щелочах. Осадок отфильтровали, прокалили до постоянной массы и взвесили, масса его после прокаливания составила 2,83 г. Фильтрат прокипятили и выпарили, полученный остаток представлял собой индивидуальное вещество Г.
А) Определите вещество А. Приведите его название.
Б) Напишите уравнения описанных реакций.
В) предложите метод синтеза вещества А из простых веществ.
Г) Что получится при взаимодействии вещества А с ацетофеноном (метилфенилкетоном), метилформиатом?
№3
Ниже приведена схема превращений соединений элемента Х
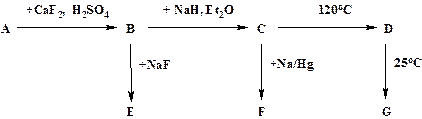
Известно, что А – слабая кислота, F – сильный восстановитель, D и G – бинарные соединения элемента Х, содержащие 17,05 и 18,94 % (массовых) водорода, соответственно.
Соединение А при нагревании с “ aqua vita ” и небольшим количеством купоросного масла горит зелёным пламенем.
1) Определите элемент Х.
2) Определите вещества A – G и напишите все уравнения реакций.
3) Какие процессы протекают при растворении кислоты А в воде?
4) Предложите пространственную структуру молекулы G.
5) Предложите два метода синтеза вещества С кроме приведённого в схеме.
6) Напишите уравнение реакции кислоты А с фторидом натрия.
№4
В ампулу объемом 100 мл поместили 10,00 г карбоната лития, запаяли под вакуумом и нагрели до 600 оС. При этом давление в ампуле составило 2602 мм рт. ст.
Если в такую же ампулу поместить 10,00 г графита и заполнить ее углекислым газом при атмосферном давлении, а затем запаять и нагреть от 25 оС до 600 оС, то давление в ампуле возрастает в 3,38 раз, при этом масса твердого вещества уменьшится на 0,006 г.
Как изменится в обоих опытах давление, если а) уменьшить массу твердого вещества вдвое? б) увеличить объем ампулы в 2 раза? Дайте обоснованный качественный ответ.
При проведении расчетов термическим расширением материала ампулы пренебречь. Считать объем твердой фазы пренебрежимо малым по сравнению с объемом ампулы.
№5
Восстановление ароматических соединений под действием щелочных металлов в жидких безводных алкиламинах (реакция Бенкезера) позволяет в зависимости от условий проведения реакции получать различные соединения. Например, реакция нафталина с литием в этиламине при –78 °С дает смесь двух изомерных соединений (А и В). Каждый из продуктов (А и В) легко реагируют с бромом, образуя продукты C и D, содержащие по 53,98% Br (по массе). Озонирование А и В дает изомерные продукты Е и F, соответственно. Взаимодействие 0,1346 г вещества F с аммиачным раствором оксида серебра приводит к выделению 0,1726 г серебра. Вещество Е с аммиачным раствором оксида серебра не реагирует.
1. Установите строение соединений A – F.
2. Напишите схемы указанных в задаче превращений.
3. Какой из продуктов (А или В) образуется в большем количестве и почему?
4. Почему, по Вашему мнению, введение алкильных заместителей в молекулу нафталина приводит к снижению скорости реакции?
5. С какой целью при проведении озонирования в реакционную смесь добавляют какой-нибудь восстановитель?
№6
Смесь паров веществ X и Y в соотношении 1:3 (по объему) имеет плотность по водороду 33,25, а в соотношении 3:1 – 45,75. Эмульсию 4,78 г сополимера Z, образованного веществами X и Y, обработали раствором брома в четыреххлористом углероде. При этом в реакцию вступило 8,00 г брома. Вычислите соотношение звеньев X и Y в Z.
В результате длительного нагревания X и Y в толуоле образуется соединение A, при дегидрировании которого можно получить углеводород B с массовой долей углерода 93,51%.
Изобразите структурные формулы A, B, X, Y.
№7
Смесь алкана и алкена с равным числом атомов водорода в молекулах общим объемом 3,92 л (н.у.) пропустили последовательно через склянки со слабощелочным раствором перманганата калия и с бромной водой. Масса первой склянки увеличилась на 0,7 г, а второй – на 1,4 г. Относительная плотность по водороду смеси газов на выходе из второй склянки составила 18. Вычислите массовые доли углеводородов в исходной смеси.
Класс
Авторы заданий – Миссюль А.Б. (№ 1), Гусев И.М. (№ 2), Скрипкин М.Ю. (№ 3), Байгозин Д.В. (№№ 4-6), Ростовский Н.В. (№ 7)
№1
Работа литий-ионных аккумуляторов основана на обратимом переносе ионов лития между катодом и анодом. Типичная конструкция содержит в качестве анодного материала графит, в качестве катодного – LiCoO2.
Определите, какие вещества образуются при зарядке такого аккумулятора, если известно, что:
1. При взаимодействии 100 мг заряженного анодного материала с водой образуется 14,18 мл (н.у.) газа.
2. При обработке 100 мг заряженного катодного материала избытком соляной кислоты и пропускании полученного газа через водный раствор KI образуется раствор, на титрование которого расходуется 15,9 мл 0,1 н раствора Na2S2O3.
Емкость аккумулятора смартфона Samsung Galaxy SIII составляет 2100 мА·ч, а вес телефона 133 г. Какие массы графита и LiCoO2 необходимо взять, чтобы получить аккумулятор такой емкости? (Побочными процессами в аккумуляторе пренебречь.) Какую долю массы телефона составляют материалы аккумулятора?
№2
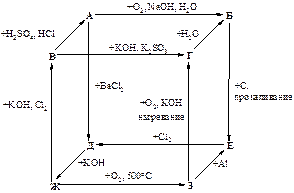 Ниже приведена схема превращений элемента Е, соединения которого играют важнейшую роль в процессе фотосинтеза. Известно, что взаимодействием минерала Б с "морской" кислотой было впервые получено простое вещество, кислородсодержащие соединения которого широко используются в качестве отбеливателя. Соединение В кроме Е содержит 24,7 % массовых долей калия и 40,5% кислорода. Определите вещества А – З, напишите все уравнения реакций.
Ниже приведена схема превращений элемента Е, соединения которого играют важнейшую роль в процессе фотосинтеза. Известно, что взаимодействием минерала Б с "морской" кислотой было впервые получено простое вещество, кислородсодержащие соединения которого широко используются в качестве отбеливателя. Соединение В кроме Е содержит 24,7 % массовых долей калия и 40,5% кислорода. Определите вещества А – З, напишите все уравнения реакций.
№3
При определении состава газообразных соединений нередко реакцию проводят непосредственно в масс-спектрометре с последующей идентификацией присутствующих в газовой фазе молекулярных ионов по значениям m/z (отношение массы молекулярного иона (а.е.м.) к его заряду (в единицах е)). При этом прибор обычно калибруется таким образом, чтобы определять только положительные значения m/z при z =1.
В масс-спектрометр ввели пары двух простых веществ. При этом зарегистрировали две группы сигналов со значениями m/z 162 и 164, вторую – со значениями m/z 464, 466, 468, 470, 472, 474 и 476.
А) определите, какие вещества были введены в масс-спектрометр;
Б) определите, какие продукты образовались при взаимодействии этих веществ;
В) какова пространственная структура этих продуктов? Ответ аргументируйте;
Г) каково соотношение интенсивностей двух крайних сигналов внутри этих двух групп?
Д) Какие новые группы сигналов будут регистрироваться при повышении температуры в масс-спектрометре?
№4
В органическом синтезе важное значение имеют доступные высокоактивные реагенты. К ним относится вещество Х, легко получаемое при взаимодействии метилового эфира муравьиной кислоты и пентахлорида фосфора. Х вступает в реакции со многими органическими веществами. Некоторые реакции и свойства образующихся органических продуктов приведены в таблице:
| Реакция | Продукт | Массовая доля углерода в продукте, % | Температура кипения продукта, °С | Некоторые свойства продукта |
| HCOOCH3 + PCl5 при 20°С | Х | 20,89 | Положительная проба Бейльштейна | |
| CH3-COOH + X | A | 30,60 | Положительная проба Бейльштейна. Бурно реагирует с водой | |
| CH3-CO-CH3 + X | B | 31,89 | Положительная проба Бейльштейна | |
| C6H6 + X+ TiCl4, затем Н2О | C | 79,23 | Отрицательная проба Бейльштейна. Легко окисляется. | |
| CH3ONa + X | D | 45,27 | Отрицательная проба Бейльштейна. Легко гидролизуется водными растворами кислот, но не щелочей |
Примечание. Проба Бейльштейна: медная проволочка, смоченная веществом, вносится в пламя горелки. Проба положительна, если пламя окрашивается в голубовато-зеленый цвет.
1. Какой реагент обозначен буквой Х? Предложите еще один способ его синтеза.
2. Какие вещества обозначены буквами A–D? Напишите схемы соответствующих превращений.
3. Какова предположительная структура продукта взаимодействия Х с C6H6 до взаимодействия с Н2О?
4. Объясните химическую основу пробы Бейльштейна.
№5
Алкилсульфаты являются важными поверхностно-активными веществами, но их широкое использование приводит к загрязнению окружающей среды. Основным процессом их разрушения в природе является гидролиз, исследование которого представляет большой интерес. Для исследования зависимости кинетики гидролиза от рН среды был выбран неопентилсульфат калия, (CH3)3CCH2OSO3K (I). Результаты исследования оказались достаточно неожиданными.
Во-первых, если при гидролизе в кислой среде образовывался ожидаемый неопентиловый спирт, то в нейтральной или щелочной – изомерный продукт (II). При небольшом нагревании с водным раствором серной кислоты II образует газообразный продукт III, озонирование которого дает смесь IV и V, причем IV является популярным растворителем.
Во-вторых, наблюдаемая константа скорости реакции гидролиза I зависела от рН и имела значение k набл = 2,3·10–1· с Н+ + 2,7·10–6 с–1.
1. Определите строение продукта гидролиза I в нейтральных и щелочных средах. Напишите уравнения всех упомянутых в задаче превращений.
2. Постройте график зависимости lg k набл от рН в диапазоне от 2 до 10, объясните его вид.
3. Напишите кинетические уравнения для гидролиза I в неопентиловый спирт, соединение II и суммарное кинетическое уравнение гидролиза I. Определите соотношение неопентилового спирта и продукта II при рН 5.
4. Объясните, почему попадание некоторых бактерий в почву резко ускоряет разложение присутствующих в почве алкилсульфатов.
№6
В рамках программы поиска интересных для парфюмерной промышленности соединений был синтезирован о -эвгенол (F) – изомер природного эвгенола. Синтез был осуществлен по схеме:
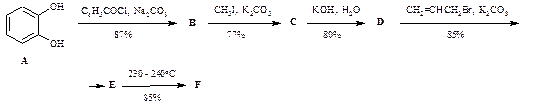
Вещества A, B, D, F дают характерное окрашивание при взаимодействии с раствором FeCl3, вещества С и Е – нет. Соединения Е и F являются изомерами с молекулярной формулой С10Н12О2. Для установления точной структурной формулы о -эвгенола его обработали сначала безводным хлористым водородом, а образовавшееся производное (G) – спиртовым раствором КОН. Образовавшийся продукт (H) имеет молекулярную формулу С10Н12О2 и не взаимодействует с раствором FeCl3.
1. Установите строение о -эвгенола и соединений В–Е и G–Н.
2. Рассчитайте общий выход о -эвгенола.
3. Почему при добавлении раствора FeCl3 к некоторым веществам образуются окрашенные растворы?
№7
Поиск и синтез пористых органических молекул является актуальной задачей для получения металл-органических пористых полимеров. Вещество Х – возможная основа для таких материалов. Синтез Х описывается следующей схемой:
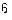
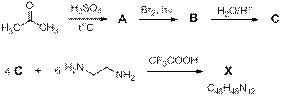
Соединение A (углеводород, содержащий 90 % углерода) имеет два, а вещество Х – три типа атомов водорода (по данным спектров ЯМР 1Н). Вещество В содержит 80.8 % брома.
Вопросы.
1. Расшифруйте схему синтеза Х и напишите структурные формулы соединений А, В, С и X.
2. Возможно ли использование на стадии B – C раствора щёлочи?
3. Какова роль СF3COOH на стадии получения Х?
Date: 2015-07-27; view: 2063; Нарушение авторских прав