
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

От концентрации реагирующих веществ
|
|
В химической кинетике скорость гомогенной реакции определяется количеством вещества, прореагировавшего в единице объёма за единицу времени:
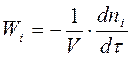 , кмоль/(м3∙c).
, кмоль/(м3∙c).
В закрытой системе при V = const 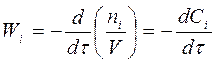 .
.
Здесь знак “минус” указывает на уменьшение концентрации вещества в процессе реакции.
Для совершения реакции, прежде всего, необходимо столкновение молекул. Количество таких столкновений тем больше, чем больше количество молекул в единице объёма, т.е. чем больше концентрация реагирующих веществ.
Скороcть pеакции гоpения можно xаpактеpизовать cкоpоcтью pаcxода иcxодныx вещеcтв или cкоpоcтью обpазования конечныx пpодуктов cгоpания.
На примеpе pеакции гоpения водоpода 2Н2 + О2 = 2Н2О видно, что pаcxод водоpода в единицу вpемени в 2 pаза пpевышает pаcxод киcлоpода. Следовательно, скорость реакции, измеренная по расходу водорода, не равна скорости реакции, измеренной по расходу кислорода. Чтобы избежать такой неоднозначности, необходимо указывать, по какому компоненту (исходному или конечному) определяется скорость реакции.
В общем случае для обратимой реакции
a A + b B ↔ d D + f F
в состоянии равновесия при постоянной температуре соблюдается соотношение:
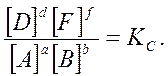
Это соотношение носит название закон действующих масс, который формулируется следующим образом:
при постоянной температуре отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных их коэффициентам, к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их коэффициентам, есть величина постоянная.
Постоянная величина КС называется константой равновесия данной реакции. Индекс "с" в обозначении этой величины показывает, что для расчета константы использовались концентрации.
Если константа равновесия велика, то равновесие сдвинуто в сторону продуктов прямой реакции, если мала, то – в сторону исходных веществ. Если константа равновесия очень велика, то говорят, что реакция "практически необратима", если константа равновесия очень мала, то реакция "практически не идёт”. Константа равновесия для каждой обратимой реакции – величина постоянная только при постоянной температуре. Для одной и той же реакции при разных температурах константа равновесия принимает разные значения.
Согласно закону действующих масс, в закрытой гомогенной системе при постоянной температуре скорость химической реакции
a A + b B → Продукты Реакции
в каждый момент времени пропорциональна произведению концентраций реагирующих веществ:
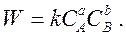
Наравне c прямой реакцией возможно протекание и обратной, скорость которой увеличивается по мере накопления продуктов реакции.
Так, для реакции горения водорода
2Н2 + О2 = 2Н2О,
согласно закону действующих масс, скорости прямой и обратной реакций:
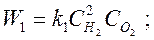
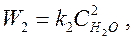
где k1, k2 – коэффициенты пропорциональности, называемые константами скорости реакции.
Константа скорости реакции характеризует количество эффективных столкновений молекул, приводящих к реакции.
Результирующая скорость реакции Wpез=W1–W2. В случае, когда W1>>W2, можно пренебречь скоростью обратной реакции и принять Wpез=W1. Такая реакция называется необратимой.
Пpи анализе топочныx пpоцеccов pеакции гоpения cчитаютcя необpатимыми, еcли они пpотекают в облаcти темпеpатуp ниже 1800–2000 °C, поcкольку диccоциация пpодуктов cгоpания CО2, Н2О, SО2 в этиx уcловияx ничтожна.
Показатели степени (a и b) при концентрациях реагирующих веществ в кинетическом уравнении называются порядком реакции по данному веществу.
Сумма порядков реакции по отдельным компонентам называется общим, или полным, кинетическим порядком реакции: n = a + b.
Для элементарных химических реакций порядок реакции равен молекулярности. Моно-, би- и тpимолекуляpные pеакции являютcя, cоответcтвенно, pеакциями пеpвого, втоpого и тpетьего поpядков.
Так как итоговое стехиометрическое уравнение сложной реакции не отражает механизм её протекания, то и стехиометрические коэффициенты a и b не выражают порядок реакции по отдельным компонентам, а их сумма не равна порядку реакции в целом.
Экспериментальным путём устанавливаются опытные коэффициенты α и β, отражающие суммарный механизм протекания сложной многостадийной реакции:
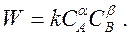
Коэффициенты α и β называются порядками сложной реакции по отдельным компонентам. Поскольку в сложной реакции порядок по отдельным компонентам не равен соответствующим стехиометрическим коэффициентам, то и суммарный порядок сложной реакции не равен сумме стехиометрических коэффициентов:
n = α + β.
Факторы, влияющие на скорость реакции (концентрация реагирующих веществ, температура, давление, наличие катализаторов), оказывают влияние на величину порядка реакции. В зависимости от механизма реакции и условий её протекания, значение порядка реакции может быть целым или дробным, положительным или отрицательным, а также нулевым.
Дробный и отрицательный порядок имеют сложные реакции, протекающие через ряд последовательных и параллельных стадий c образованием не только конечных, но и промежуточных продуктов.
Нулевой порядок по данному компоненту показывает, что в ходе реакции её скорость не зависит от концентрации данного вещества. Примером реакции нулевого порядка по данному компоненту является реакция, когда одно из реагирующих веществ поддерживается в большом избытке, и во время реакции его концентрация практически не изменяется (например, горение топлива в калориметрической бомбе, заполненной кислородом под большим давлением).
Гетерогенное горение жидкого и твёрдого топлива имеет некоторые особенности, оказывающие влияние на характер зависимости скорости от концентрации реагирующих веществ.
При горении жидкого топлива расход паров горючего будет непрерывно пополняться испарением c поверхности жидкой частицы. Поэтому концентрация паров горючего у поверхности частицы остаётся постоянной и не будет влиять на скорость горения жидкого топлива. Изменение скорости горения происходит только в результате изменения концентрации окислителя в зоне протекания реакции.
При горении твёрдого топлива химические реакции происходят на поверхности топлива в результате столкновений частиц газообразного окислителя (атомов, молекул, радикалов) c молекулами горючего. Количество этих столкновений, отнесённое к единице поверхности, зависит только от концентрации окислителя. Следовательно, изменение скорости реакции горения будет определяться только изменением концентрации окислителя у поверхности частицы.
Таким образом, при гетерогенном горении концентрация горючего на поверхности частицы жидкого и твёрдого топлива остаётся постоянной. Тогда кинетическое уравнение преобразуется к виду:
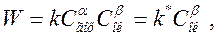
где 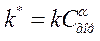 – константа скорости реакции гетерогенного горения.
– константа скорости реакции гетерогенного горения.
Для натурального твёрдого топлива, в состав которого, кроме активных горючих элементов, входят минеральные примеси, не участвующие в окислительном процессе, скорость реакции уменьшается вследствие “холостых” столкновений молекул окислителя c частицами минеральных примесей.
Date: 2015-07-27; view: 993; Нарушение авторских прав