
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Рассчитаем температуру вспышки
а) по Табл.6 приложения определим температуру кипения пропилового спирта: t кип = 97,8 оС
б) определим k - к-т горючести, зависящий от содержащихся в молекуле атомов:
k = 4´”C” + 4´”S” + ”H” + ”N” – 2´”O” – 2´”Cl” – 3´”F” – 5´”Br”, где
”C”, ”S”, ”H”, ”N”, ”O”, ”Cl”, ”F”, ”Br” - количество атомов соотв. элемента в молекуле ГВ.
В молекуле пропилового спирта: 3 атома С, 7 атомов Н, 1 атома О, тогда
k = 4´3 +7 - 2´1 =17
в) определим температуру вспышки по формуле Элея:
tвс = tкип -18  , tвс = 97,8 - 18
, tвс = 97,8 - 18  = 23,64 оС,
= 23,64 оС,
12. Рассчитаем  давление при взрыве паров при стехиометрической концентрации, считая что tвз = tг
давление при взрыве паров при стехиометрической концентрации, считая что tвз = tг
Рвз = 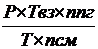 =
= 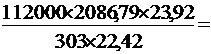 8228744,3 Па,
8228744,3 Па,
Где: Твз = t вз + 273 = 1813,791 + 273 = 2086,791 К
nпг = nСО2+ nН2О +nN2 = 3 + 4 + 4,5´3,76 = 23,92 Кмоль
nсм = nгв + nО2 + nN2 = 1 + 4,5 +4,5´3,76 = 22,42 Кмоль
Выводы:
Определены показатели пожарной опасности пропилового спирта при заданных параметрах
1. Расход воздуха на горение Vв = 9,57 м3
2. Объём и процентный состав продуктов горения Vпг = 10,49м3
jСО2 =10,58%
jН2О = 14,1 %
jО2 = 3,33 %
jN2 = 71,97 %
3. Низшая теплота сгорания Qн = 31205,3 кДж / кг
| 4. | Плотность паров по воздуху d = 2,06, т.е. пары пропилового спирта ≈ в 2 раза тяжелее воздуха. | |
| 5. | Давление и концентрация насыщенных паров: Рнас @3679 Па; jнас =3,3@3%; Снас = 80,57 г/м3 . | |
| 6. | Стехиометрическая концентрация паров (в % по объёму и в г/м3): jст = 4,46 % Сст = 119,78 г/м3 | |
| 7. | Концентрационные пределы распространения пламени j н,(НКПР) = 2,28 % о С в,(ВКПР) = 13,28 % Сн = 61,23 г/м3 Св = 356,66 г/м3 | |
| 8. | Время образования взрывоопасной концентрации паров t = 5620,91 с =93,68 мин = 1,56 часа ≈ 2 часа | |
| 9. | Температурные пределы распространения пламени tн (НТПР) = 286,53 К = 13,53 оС tв (ВТПР) = 307,11 К=34,11 оС Безопасными для режимов хранения, перевозки, перекачки являются температуры до 13,53 оС и выше 34,11 оС |
10. Температура вспышки tвс = 23,64 оС, т.е. пропиловый спирт является ЛВЖ II-го разряда (постоянно опасным).
11. Температура горения tгор =1813,7910С
12. Максимальное давление взрыва
Рвз=8228744,3 Па
Заключение
Горение - это химическая реакция окисления, сопровождающаяся выделением большого количества тепла и свечением.
В зависимости от скорости протекания процесса, горение может происходить в форме собственно горения и взрыва.
Для процесса горения необходимо:
1) наличие горючей среды, состоящей ив горючего вещества и окислителя; 2) источника воспламенения.
Чтобы возник процесс горения, горючая среда должна быть нагрета до определенной температуры при помощи источника воспламенения (пламя, искра электрического или механического происхождения, накаленные тела, тепловое проявление химической, электрической или механической энергий).
После возникновения горения постоянным источником воспламенения является зона горения. Возникновение и продолжение горения возможно при определенном количественном соотношении горючего вещества и кислорода, а также при определенных температурах и запасе тепловой энергии источника воспламенения. Наибольшая скорость стационарного горения наблюдается в чистом кислороде, наименьшая - при содержании в воздухе 14 - 15% кислорода. При меньшем содержании кислорода в воздухе горение большей части веществ прекращается.
Date: 2015-07-27; view: 786; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |