
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Образование комплексных соединений
|
|
Опыт 1. Образование амминокомплекса серебра.
Наливаю в пробирку 3-4 капли раствора нитрата серебра, добавляю столько же раствора хлорида натрия (или хлорида калия).
AgNO3+NaCl=AgCl+NaNO3


Выпал белый осадок хлорида серебра. Затем в вытяжном шкафу добавляю в пробирку 3-5 капель концентрированного раствора аммиака и несколько раз встряхнула.
AgCl+2NH4OHK=[Ag(NH3)2]Cl+2H2O

Осадок растворился вследствие образования амминокомплекса серебра.
Опыт 2. Получение амминокомплекса никеля.
2NiSO4+2NH4OH=(NiOH)2SO4  +(NH4)2SO4
+(NH4)2SO4
образовался студенистый осадок сульфата гидроксоникеля.
(NiOH)2SO4+(NH4)2SO4+10NH4OH=2[Ni(NH3)6]SO4+12H2O
Получился раствор синего цвета.
Добавим 1мл насыщенного раствора бромида калия до выпадения в осадок бромида гексамминоникеля.

Опыт 3. Образование амминокомплекса меди.
Наливаю в пробирку 3-5 капель раствора сульфата меди (II) и добавляю по каплям концентрированный раствор аммиака.
CuSO4+4NH4OH=[Cu(NH3)4]SO4+4H2O
В первый момент выделяется синий осадок сульфата гидроксомеди (II), который затем растворяется вследствие образования амминокомплекса меди.
Опыт 4. Получение комплексного йодида ртути.
Наливаю в пробирку 3-4 капли раствора нитрата ртути (II) и добавляю 1-2 капли раствора йодида калия.
Hg(NO3)2+2KJ=HgJ2+2KNO3
Образуется оранжевый осадок дийодида ртути. В пробирку по каплям добавляем избыток раствора йодида калия до полного растворения полученного осадка, которое обусловлено образованием в растворе комплексных анионов тетрайодомеркурата (2-).
HgJ2+2KJ=K2[Hg(J)4]
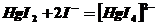
Этот анион можно выделить в осадок ионами серебра или кобальта (2+). Разделяю раствор тетрайодомеркурата на две части. В первую пробирку добавляю 1-2 капли раствора нитрата серебра, во вторую –1-2 капли раствора сульфата кобальта (II).
K2[Hg(J)4]+ Ag(NO3)2=Ag[Hg(J)4]+ 2KNO3
Выпадает желтый осадок.
K2[Hg(J)4]+ CoSO4=Co[Hg(J)4]+K2SO4
Выпадает розовый осадок.
Примечание: соли ртути ядовиты.
Опыт 5. Образование гидрокомплекса цинка.
Наливаю в пробирку 3-4 капли раствора сульфата цинка и добавляю по каплям 0,2 н. раствор гидроксида натрия, находящийся в штативе с реактивами, до выпадения осадка гидроксида цинка.
ZnSO4+2NaOH=Zn(OH)2+Na2SO4
Выпадает студенистый осадок. Затем в вытяжном шкафу добавляю по каплям 6 н. раствор едкого натра до полного растворения осадка вследствие образования комплексного аниона тетрагидроксоцинка (2-).
Zn(OH)2+NaOH(6N)=Na2[Zn(OH)4]
2. Реакции с участием комплексных соединений, не сопровождающиеся разрушением комплексного иона.
Опыт 6. Образование труднорастворимого гексаноциферрата (III).
А. Наливаю в пробирку 3-4 капли раствора гексаноциферрата (II) калия K4[Fe(CN)6]. Добавляю 2-3 капли раствора трихлорида железа.
3K4[Fe(CN)6]+4FeCl3=Fe4[Fe(CN)6]3  +12KCl
+12KCl
Выпадает осадок цвета берлинской лазури, используемой для производства художественных красок. Реакция служит для обнаружения катионов Fe3+.
Б. Наливаю в пробирку 3-4 капли раствора гексацианоферрата (III) калия K3[Fe(CN)6]. Добавляю 2-3 капли раствора сульфата железа (II).
2K3[Fe(CN)6]+3FeSO4=Fe3[Fe(CN)6]2  +3K2SO4
+3K2SO4
Образуется осадок, который в прошлом веке называли турнбулевой синью. В настоящее время установлено, что берлинская лазурь и турнбулева синь – одно и то же вещество, а именно: гексаноциферрат (III) железа (II) Fe3[Fe(CN)6]2. Данная реакция служит для обнаружения катионов Fe2+.
Опыт 7. Образование труднорастворимых гексаноциферратов (II).
Наливаю в две пробирки по 3-4 капли раствора гексаноциферрата (II) калия. В первую пробирку добавляю 2-3 капли раствора сульфата цинка, во вторую – столько же раствора сульфата меди (II).
2K4[Fe(CN)6]2+3ZnSO4=K2Zn3[Fe(CN)6]2+3K2SO4(1 пробирка)
2K4[Fe(CN)6]2+3CuSO4=K2Cu3[Fe(CN)6]2+3K2SO4(2 пробирка)
В первой пробирке образуется желтый густой осадок, а во второй пробирке образуется зеленый осадок.
Опыт 8. Образование труднорастворимого гексанитрокобальта (III) натрия-калия.
Реакция служит для обнаружения в растворах катионов калия. Наливаю в пробирку 3-4 капли раствора Na3[Co(NO2)6] и добавляю 2-3 капли раствора хлорида калия.
Na3[Co(NO2)6]+2KCl=K2Na[Co(NO2)6]  +2NaCl
+2NaCl
Образуется густой желтый осадок комплексной соли K2Na[Cp(NO2)6].
3. Реакции, сопровождающиеся разрушением комплексных ионов.
Опыт 9. Образование и разрушение амминокомплекса никеля.
Наливаю в пробирку 3-4 капли раствора сульфата никеля (II) и добавляю 2-3 капли концентрированного раствора аммиака до полного растворения образующегося в первый момент синего осадка сульфата гидроксоникеля. Образутся раствор синего цвета, обусловленного катионом гексаамминоникеля (2+)
NiSO 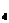 + 2NH
+ 2NH 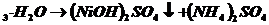

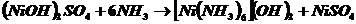
Затем добавляю в раствор 15 %-ную соляную кислоту до изменения синей окраски в жёлтую.

Ni- d-элемент. При замене лигандов  на
на 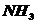 увеличивается скорость расщепления молекул, что пиводит к сдвигу полос поглощения в сторону меньших длин волн. При переходе к хлорокомплексу меняется координационное число с 6 до 4: окраска ослабевает, т.е. сдвиг полос поглощения смещается в сторону больших длин волн.
увеличивается скорость расщепления молекул, что пиводит к сдвигу полос поглощения в сторону меньших длин волн. При переходе к хлорокомплексу меняется координационное число с 6 до 4: окраска ослабевает, т.е. сдвиг полос поглощения смещается в сторону больших длин волн.
Следовательно комплексообразование, характерное для d-элементов позволяет растворять осадки некоторых соединений этих элементов, т.е. переводить их в раствор.
Порядок выполнения работы:
Date: 2015-07-27; view: 1059; Нарушение авторских прав