
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Cхема тримолекулярных взаимодействий, использующая симметризованный набор бимолекулярных актов
|
|
Как уже говорилось выше для того чтобы произошел тримолекулярный элементарный акт, необходимо, чтобы произошло соударение трех частиц. Строго одновременное соударение трех частиц имеет нулевую вероятность и во всех случаях какие-то две из трех соударяющихся частиц встретятся несколько раньше, чем к ним приблизится третья частица. Поэтому тримолекулярные реакции можно рассматривать как сложный процесс, состоящий из двух бимолекулярных стадий. На первой стадии из двух частиц А1и А2 образуется промежуточная частица А1А2. Далее эта частица реагирует с молекулой А3 с образованием продуктов реакции.
Если промежуточная частица представляет собой лабильное образование с малой продолжительностью жизни и между A1 и А2 не возникает никаких прочных химических связей, то первая стадия, подобно процессу активации в случае мономолекулярных реакций, не является химическим превращением и весь процесс можно рассматривать как единый элементарный химический процесс.
Пусть на протяжении всего процесса соблюдается равенство скоростей образования частиц A1A2 и их обратного распада на A1 и А2, (т. е. имеет место равновесие между A1A2, и А1, А2):
k1.2C1C2 = k12C1.2
Здесь k1.2 — константа скорости образования A1A2, а k12 — константа скорости ее распада. Величины C1 и С2 — концентрации свободных (не связанных в комплекс) частиц A1 и А2. Поскольку речь идет о лабильных промежуточных частицах A1A2, то их концентрация мала по сравнению сC1 и С2 и, следовательно, в дальнейшем можно считать, что С1 и С2 практически совпадают с полными концентрациями А1 и А2 в системе.
Если обозначить черезk1.2.3 константу скорости реакции А1А2 с А3,то скорость образования продуктов реакции в результате этого процесса будет описываться уравнением
V = k12.3 C12 C3 =  C1 C2 C3
C1 C2 C3
Так как реакция может осуществляться также при взаимодействии А1 с промежуточной частицей А2А3 или А2 с промежуточной частицей A3A1, суммарная скорость образования продуктов тримолекулярной реакции по любому из трех возможных путей равна:
V = ( +
+  )C1C2C3
)C1C2C3
Таким образом, тримолекулярная реакция оказывается реакцией третьего порядка с константой скорости:
k =  +
+ 
Константы скорости отдельных бимолекулярных стадий можно выразить через факторы соударений, стерические факторы и энергии активации, а константы скорости мономолекулярных реакций — через предэкспоненциальные множители и энергии активации. При этом получается следующее выражение для константы скорости третьего порядка:
k = 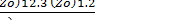 exp
exp  +
+
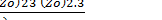 exp
exp  +
+
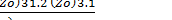 exp
exp 
Поскольку Е1,2 и Е12 — энергии активации прямой и обратной стадий, то Е1,2 и Е12, представляют собой тепловой эффект образования
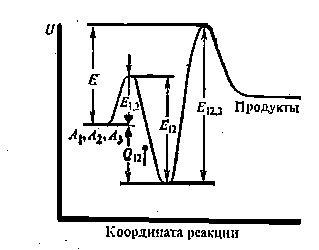
| Рисунок 5 "Энергетический барьер тримолекулярной реакции" |
А1А2, т. е. Q12. Как видно из (рис. 5), Е12,3 представляет собой высоту потенциального барьера реакции по отношению к исходным частицам А1, А2, А3, т е. является потенциальным барьером Е всего процесса:
E = E12.3 + E1.2 – E12
Аналогично:
E = E23.1 + E2.3 – E23; Е = Е31,2 + Е3,1 – Е31.
Так как p 1,2 есть вероятность взаимной ориентации A1 и А2, необходимой для протекания реакции, a p 12,3 — вероятность необходимой взаимной ориентации частицы A1A2 и частицы А3, то произведение этих величин есть вероятность необходимой взаимной ориентации всех трех частиц. Аналогичный смысл имеют произведения p 23,1 p 2,3 и p 31,2 p 3,1.
Поэтому можно считать, что:
p12.3p1.2 = p23.1p2.3 = p31.2p3.1 = p
где р — стерический фактор тримолекулярной реакции. Поэтому можно записать в виде:
k = p 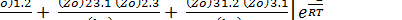
Величина
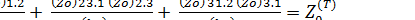 (6.1)
(6.1)
(6.1) - есть фактор соударений тримолекулярной реакции. Поскольку Z0 имеет значение 10-16 – 10 -17 м6/с, а предэкспоненциальный множитель мономолекулярной реакции равен 1013 с-1, то фактор соударений оказывается величиной, равной 10-45 – 10 -47 м6/с. Соответственно в единицах молярностиZ0 в (6,02 * 1020)2 раз больше и является величиной порядка 106 – 10 8 м6/с.
Выражение для скорости тримолекулярной реакции может быть записано, по аналогии с бимолекулярными реакциями, в виде:
V = pZ0(T)b-E/RT C1 C2 C3
а константа скорости:
k = pZ0(T)b-E/RT
Согласно методу активированного комплекса для тримолекулярной реакции:
k = æ 
Полагая к=1 и пренебрегая колебательными статистическими суммами, для предэкспоненциального множителя нетрудно получить выражение:
k0 =  (
(  )3
)3  3/2
3/2  =
=
= 
Также по аналогии с бимолекулярными реакциями величину для реакции трех атомов можно отождествить с фактором соударения:
Z0(T) = 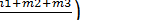 3/2
3/2  3/2
3/2  1/2 = = h2
1/2 = = h2 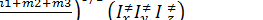 1/2
1/2
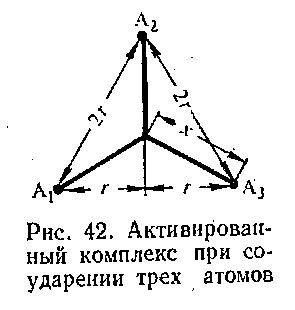
| Рисунок 6 " Активированный комплекс при соударении трех атомов" |
гдеIх≠Iу≠ Iz≠ - моменты инерции активированного комплекса относительно его главных осей инерции.
Оценить величину Z0(т)можно, допустив приближенно, что т1 — т2 = т3 и что в активированном комплексе, атомы образуют равносторонний треугольник со сторонами2r.
Главными осями инерции активированного комплекса в этом случае будут ось Оz, проходящая через центр треугольника перпендикулярно к его плоскости (рис.6), и две любые оси в плоскости треугольника, например две высоты треугольника. Это дает Iz≠ = Зmх2, где х — расстояние от центра треугольника до его вершины.
Нетрудно убедиться, что х2 =4/3r2 и отсюда
Iz≠ = 4mr2 ,аIx≠ = In≠ = 2mr3
Следовательно:
k0 = h2  = (8П)1/2 3 3/2 m -3/2 4 (kT) -1/2 r3 h2 =
= (8П)1/2 3 3/2 m -3/2 4 (kT) -1/2 r3 h2 =
=1.82 * 10 -13 M-3/2 T-1/2 r3
Если Т = 300÷1000 К, М = 5÷ 50 и r = 10 -10 м, то k0=10-45 ÷ 10-47 м6/с, что согласуется с результатом, полученным из теории соударений.
Приведенные оценки верны и для газовых бимолекулярных реакций при низких давлениях, когда они протекают как реакции третьего порядка. В выражение для константы скорости в этом случае входят в числитель две константы скорости бимолекулярных стадий:kа иkс, кроме того, в числитель входит одна, а в знаменатель две константы скорости мономолекулярных стадий:kр, k_р иk. Поэтому порядок предэкспоненциального множителя, совпадает с оценкой фактора тройных соударений по (6.1). Например реакция:
H* + O2 + O2 → O2 + HO2*
протекает при невысоких давлениях как реакция третьего порядка с нулевой энергией активации и константой скорости 1,1 >10-45 м6/с, которая в этом случае является одновременно предэкспоненциальным множителем.
Приведенные рассуждения остаются в силе и тогда, когда между какой-либо парой частиц (или между всеми тремя частицами) возникает специфическое взаимодействие и фактически образуется некоторое лабильное промежуточное соединение (промежуточный комплекс), если его концентрация мала по сравнению с полной концентрацией исходных частиц. Нельзя провести четкой границы между истинными элементарными тримолекулярными реакциями и двустадийным взаимодействием трех частиц, идущим через образование лабильного промежуточного соединения, находящегося в равновесии с исходными частицами. Поэтому последнее можно рассматривать как тримолекулярный процесс. Такого типа реакциями является, по-видимому, большинство тримолекулярных реакций в растворах [5].
Вывод
1. Результатом любого химического процесса является перестройка частиц исходных веществ в частицы продуктов реакции. Каждое превращение исходной или промежуточной частицы или нескольких частиц при их непосредственном взаимодействии друг с другом, приводящее к изменению их химического строения, являетсяэлементарным актомхимического превращения.
2. Первая попытка объяснений характерных особенностей тримолекулярных реакций принадлежит Траутцу, который рассматривалэти реакции как двустадийные процессы, элементарный акт которых осуществляется при столкновении трех частиц, состоящий из двух бимолекулярных стадий. Реакции с молекулярностью более трёх неизвестны.
3. Важными тримолекулярными реакциями являются реакции валентно-ненасыщенных и реакции рекомбинации валентно-насыщенных частиц, а также образование активированного комплекса при соударении трех атомов.
4. Химическое взаимодействие осуществляется только при столкновении активных частиц, которые обладают достаточной энергией для преодоления потенциального барьера реакции и ориентированы в пространстве друг относительно друга.
5. Наиболее характерным для тримолекулярных реакций является их отрицательный температурный коэффициент.Константа скорости зависит от температуры.Наблюдаемая на опыте константа скорости есть произведение истинной бимолекулярной константы скорости на константу равновесия, уменьшение которой с ростом температуры и приводит, к наблюдаемой аномальной температурной зависимости.
Список использованной литературы
1. Кноре. Д.Г., Крылова Л.Ф. «Физическая химия», 2 изд. М., «Высшая школа» 1990. – 416 с.
2. Краснов К.С., Воробьев Н.К., Годнев И.Н. Физическая химия. В 2кн. Кн.2. Электрохимия. Химическая кинетика и катализ. Учеб.для вузов/ Краснов К.С., Воробьев Н.К., Годнев И.Н и др.; Под ред. К.С.Краснова – 2-е издание, перераб. и доп. – М.: Высшая школа, 1995. – 319с.: ил.
3. Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ. Учебное пособие для вузов. – 3-е изд.испр. и доп. – М., Химия, 1985. 592 с., ил.
4. Стромберг А.Г., Семченко Д.П. «Физическая химия» М., «Высшая школа» 2003. – 527с.
5. ЭмануэльН.М., Кнорре Д.Г. Курс химической кинетики. Издание 4-е для вузов переработанное и дополненное – М., «Высшая школа» 1984. 402 с.
6. Интернет ресурс. Точка доступа:
http://knowledge.allbest.ru/chemistry/3c0a65635a2ad68a4d53b88421216d27_0.html
Date: 2015-07-27; view: 756; Нарушение авторских прав