
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Зависимость константы скорости тримолекулярной реакции от температуры
|
|
Наиболее характерным для тримолекулярных реакций является их отрицательный температурный коэффициент.
На (рис. 4) приведена зависимость константы скорости окисления NO от температуры в координатахk - f (T) (а) иlgk - f(T-1).Cкорость этой реакции отчетливо снижается с ростом температуры; закономерности, типа найденных Вант-Гоффом и Аррениусом, не соблюдаются. То же наблюдается и для рекомбинации: при рекомбинации атомного иода с увеличением температуры от 25° С до 125 °С константа рекомбинации уменьшается в 2—3 раза.Такимобразом, первое, что жало объяснить при теоретическом истолковании три молекулярных реакций, является аномальнаятемпературная зависимость [3].
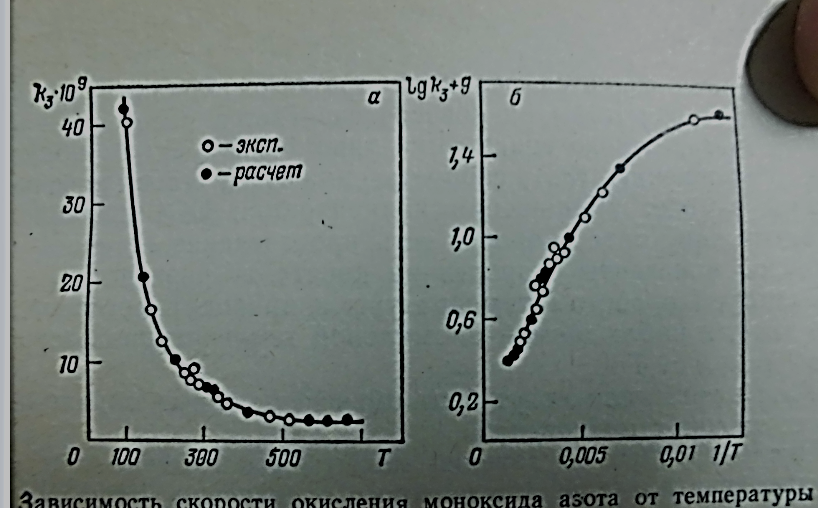
Рисунок 4«Зависимость скорости окисления моноксида азота от температуры»
Eсли подойти формально ииспользовать уравнение Аррениуса, то энергия активации получаетсяотрицательной.
Первая попытка объяснений характерных особенностей тримолекулярных реакций принадлежит Траутцу, который рассматривал эти реакции как двустадийные процессы. Первая стадия равновесна и, например, для образования нитрозилхлорида заключается в присоединении обладающей неспаренным электроном молекулы N0 к молекуле хлора
NO + CI2  → NOCI2
→ NOCI2
Поэтому:
 = k1 [NO] [Cl2] – k2[NOCl2]
= k1 [NO] [Cl2] – k2[NOCl2]
Откуда легко находим, что
[NOCl2] = K [NO] [Cl2](4.1)
где К = k1/k2 – константа равновесия
Вторая, медленная, стадия, определяющая скорость процесса в целом, является реакцией взаимодействия промежуточного соединения со второй молекулой N0
NOCl2+ N0  2N0C1
2N0C1
Следовательно, скорость реакции образования нитрозилхлорида будет равна:
d [NOCl2] / dt = k [NO] [Cl2] (4.2)
Подставляя в это выражение значение концентрации NOCl2 из выражения (4.1) получим
d [NOCl2] / dt = kK [NO]2 [Cl2] (4.3)
т. е. процесс является реакцией третьего порядка. По Траутцу, с ростом температуры равновесие сдвигается в сторону диссоциации промежуточного соединения типа NOCI2. Таким образом, согласно уравнению (4.2), скорость снижается с повышением температуры за счет уменьшения концентрации NOCI2. Наблюдаемая на опыте константа скорости есть произведение истинной бимолекулярной константы скорости на константу равновесия, уменьшение которой с ростом температуры и приводит, согласно уравнению (4.3), к наблюдаемой аномальной температурной зависимости k от Т и lgk от T-1.
Date: 2015-07-27; view: 750; Нарушение авторских прав