
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Классификация белков
|
|
В организме человека содержится свыше 50 000 индивидуальных белков, отличающихся первичной структурой, конформацией, строением активного центра и функциями. Однако до настоящего времени нет единой и стройной классификации, учитывающей различные особенности белков. В основе имеющихся классификаций лежат разные признаки. Так белки можно классифицировать:
по форме белковых молекул (глобулярные – округлые или фибриллярные – нитевидные)
по молекулярной массе (низкомолекулярные, высокомолекулярные)
по выполняемым функциям (транспортные, структурные, защитные, регуляторные и др.)
по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.)
по структурным признакам и химическому составу белки делятся на две группы: простые и сложные. Простые белки представлены только полипептидной цепью, состоящей из аминокислот. Сложные белки имеют в своем составе белковую часть и небелковый компонент (простетическую группу). Однако и эта классификация не является идеальной, поскольку в чистом виде простые белки встречаются в организме редко.
Характеристика простых белков.
К простым белкам относят гистоны, протамины, альбумины и глобулины, проламины и глютелины, протеиноиды.
Гистоны - тканевые белки многочисленных организмов, связаны с ДНК хроматина. Это белки небольшой молекулярной массы (11-24 тыс.Да). По электрохимическим свойствам относятся к белкам с резко выраженными основными свойствами (поликатионные белки), ИЭТ у гистонов колеблется от 9 до 12. Гистоны имеют только третичную структуру, сосредоточены в основном в ядрах клеток. Гистоны связаны с ДНК в составе дезоксирибонуклеопротеинов. Связь гистон-ДНК электростатическая, так как гистоны имеют большой положительный заряд, а цепь ДНК-отрицательный. В составе гистонов преобладают диаминомонокарбоновые аминокислоты аргинин, лизин.
Выделяют 5 типов гистонов. Деление основано на ряде признаков, главным из которых является соотношение лизина и аргинина во фракциях, четыре гистона Н2А, Н2В, Н3 и Н4 образуют октамерный белковый комплекс, который называют «нуклеосомный кор». Молекула ДНК «накручивается» на поверхность гистонового октамера, совершая 1,75 оборота (около 146 пар нуклеотидов). Такой комплекс гистоновых белков с ДНК служит основной структурной единицей хроматина, ее называют «нуклеосома».
Основная функция гистонов - структурная и регуляторная. Структурная функция состоит в том, что гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно, хроматина и хромосом. Регуляторная функция заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Протамины - своеобразные биологические заменители гистонов, но отличаются от них составом и структурой. Это самые низкомолекулярные белки (М - 4-12 тыс. Да), обладают резко выраженными основными свойствам из-за большого содержания в них аргинина (80%).
Как и гистоны, протамины - поликатионные белки. Они связываются с ДНК в хроматине спермиев и находятся в молоках рыб.
Сальмин - протамин из молоки лосося.
Скумбрин - из молоки скумбрии.
Протамины делают компактной ДНК сперматозоидов, т.е. выполняют как и гистоны, структурную функцию, однако не выполняют регуляторную.
Альбумины и глобулины.
Альбумины (А) и глобулины (Г).
А и Г белки, которые есть во всех тканях. Сыворотка крови наиболее богата этими белками. Содержание альбуминов в ней составляет 40-45 г/л, глобулинов 20-30 г/л, т.е на долю альбуминов приходится более половины белков плазмы крови.
Альбумины-белки относительно небольшой молекулярной массы (15-70 тыс. Да); они имеют отрицательный заряд и кислые свойства, ИЭТ - 4,7, содержат много глутаминовой аминокислоты. Это сильно гидратированые белки, поэтому они осаждаются только при большой концентрации водоотнимающих веществ.
Благодаря высокой гидрофильности, небольшим размерам молекул, значительной концентрации альбумины играют важную роль в поддержании осмотического давления крови. Если концентрация альбуминов ниже 30 г/л, изменяется осмотическое давление крови, что приводит к возникновению отеков. Около 75-80 % осмотического давления крови приходится на долю альбуминов.
Характерным свойством альбуминов является их высокая адсорбционная способность. Они адсорбируют полярные и неполярные молекулы, выполняя транспортную роль. Это неспецифические переносчики они транспортируют гормоны, холестерол, билирубин, лекарственные вещества, ионы кальция. Связывание и перенос длинноцепочных жирных кислот - основная физиологическая функция сывороточных альбуминов. Альбумины синтезируются преимущественно в печени и быстро обновляются, период их полураспада 7 дней.
Глобулины - белки с большей, чем альбумины молекулярной массой. Глобулины слабокислые или нейтральные белки (ИЭТ = 6 – 7,3). Некоторые из глобулинов обладают способностью к специфическому связыванию веществ (специфические переносчики).
Возможно фракционирование белков сыворотки крови на альбумины и глобулины методом высаливания с помощью (NH4)2SO4. В насыщенном растворе осаждаются альбумины как более легкая фракция, в полунасыщенном – глобулины.
В клинике широкое распространение получил метод фракционирования белков сыворотки крови путем электрофореза. При электрофоретическом разделении белков сыворотки крови можно выделить 5–7 фракций: Характер и степень изменения белковых фракций сыворотки крови при различных патологических состояниях представляет большой интерес для диагностических целей. Уменьшение альбуминов наблюдается в результате нарушения их синтеза, при дефиците пластического материала, нарушении синтетической функции печени, поражении почек. Содержание глобулинов увеличивается при хронических инфекционных процессах.
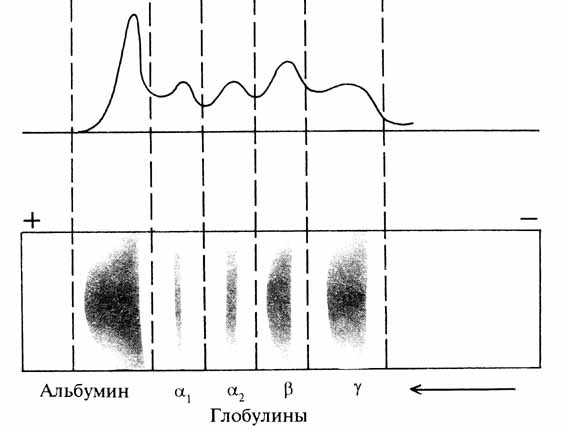

Электрофорез белков сыворотки крови.
Проламины и глютелины.
Это группа растительных белков, которые содержатся исключительно в клейковине семян злаковых растений, где выполняют роль запасных белков. Характерной особенностью проламинов является то, что они не растворимы в воде, солевых растворах, щелочах, но растворимы в 70% растворе этанола, в то время как все другие белки выпадают в осадок. Наиболее изучены белки глиадин (пшеница) и зеин (кукуруза). Установлено, что проламины содержат 20-25% глутаминовой кислоты и 10-15 % пролина. Эти белки, например, глиадин, в норме у человека расщепляются, но иногда при рождении фермент, расщепляющий этот белок, отсутствует. Тогда этот белок превращается в продукты распада, обладающие токсическим действием. Развивается заболевание целиакия - непереносимость растительных белков.
Глютелины – тоже растительные белки, не растворимые в воде, в растворах солей, этаноле. Они растворимы в слабых щелочах.
Протеиноиды.
Белки опорных тканей (костей, хрящей, сухожилий, связок), кератины - белки волос, рогов, копыт, коллагены - белки соединительной ткани, эластин - белок эластических волокон.
Все эти белки относятся к фибриллярным, не гидролизуются в желудочно - кишечном тракте. Коллаген составляет 25-33 % от общего количества белка организма взрослого человека или 6 % от массы тела. Пептидная цепь коллагена содержит около 1000 аминокислотных остатков, из которых каждая 3-я аминокислота – глицин, 20% составляют пролин и гидроксипролин, 10% аланин. При формировании вторичной и третичной структур этот белок не может давать типичных a-спиралей, поскольку аминокислоты пролин и оксипролин могут давать только одну водородную связь. Поэтому полипептидная цепь на участке, где находятся эти аминокислоты, легко изгибается, так как не удерживается, как обычно, второй водородной связью.
Эластин – это основной структурный компонент эластических волокон, которые содержатся в тканях обладающих значительной эластичностью (кровеносные сосуды, связки, легкие). Свойства эластичности проявляются высокой растяжимостью этих тканей и быстрым восстановлением исходной формы и размера после снятия нагрузки. В составе эластина содержится много гидрофобных аминокислот (глицина, валина, аланина, лейцина, пролина).
СЛОЖНЫЕ БЕЛКИ
Сложные белки кроме полипептидных цепей содержат в своем составе небелковую (простетическую) часть, представленную различными веществами. В зависимости от химической природы небелковой части выделяют следующие группы сложных белков:
· хромопротеины
· углевод – белковые комплексы
· липид – белковые комплексы
· нуклеопротеины
· фосфопротеины
1.6.1. ХРОМОПРОТЕИНЫ
Хромопротеины – это сложные белки, простетическая часть которых представлена окрашенным компонентом (от греч. Chromos – краска). К ним относятся биологически важные белки гемоглобин, миоглобин, а также некоторые ферменты: каталаза, пероксидаза, цитохромы, все они являются гемпротеинами, так как простетическая часть их содержит гем.
Гемоглобин (Нв).
Гемоглобин имеет четвертичную структуру, молекулярная масса его 66-68 тыс.Да. Как следует из названия Нв представляет собой соединение гема с белком глобином. Это олигомерный белок, состоящий из 4 субъединиц (протомеров), соединенных нековалентными связями (гидрофобные, ионные взаимодействия, водородные связи).
Субъединицы Нв «узнают» друг друга благодаря присутствию на их поверхности комплементарных по форме участков. Каждая из субъединиц или полипептидных цепей обозначается буквами, их 4 у Нв взрослого человека (Нв А), эти цепи называются альфа (a) и бета (b). Каждая молекула Нв А содержит по две a- и по две b-цепи. Они различаются первичной структурой и длиной полипептидной цепи: a - цепи содержат по 141 аминокислотному остатку, b - цепи по 146.
Каждый из протомеров гемоглобина представляет собой природный координационный комплекс. В нем комплексообразователем служит Fe 2+. Его координационное число равно 6. Поэтому ион железа связан с 6 лигандами. 4 лиганда являются пиррольными кольцами протопорфирина. Пятая связь затрачивается на соединение с белком глобином через аминокислоту гистидин, а 6 координационная связь используется для связывания с кислородом или другими газообразными веществами (СО2, СО).
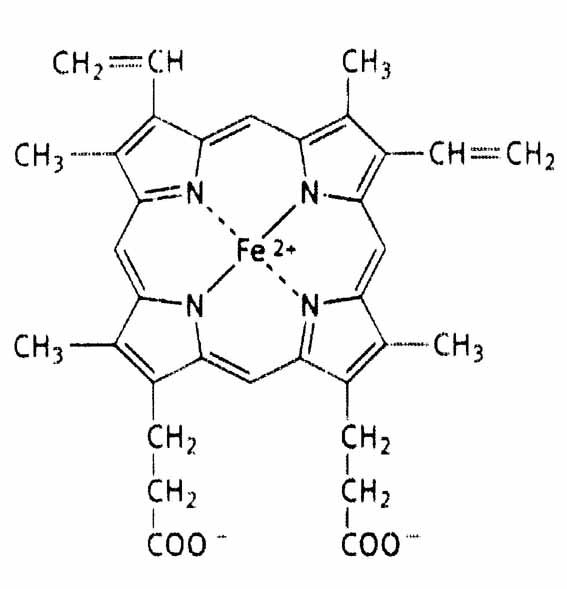

Строение гема.
Внутри каждого протомера имеется гидрофобный "карман", в котором располагается гем, способный присоединять кислород.

Схема молекулы гемоглобина.
Основная функция гемоглобина – перенос кислорода из легких к периферическим тканям. Первая молекула кислорода изменяет конформацию протомера, к которому она присоединилась. Поскольку этот протомер соединен многими связями с другими протомерами, изменяется конформация и сродство других протомеров к лигандам. Это явление называют кооперативностью изменения конформации протомеров. Изменение конформации таковы, что сродство гемоглобина ко 2-й молекуле кислорода увеличивается. В свою очередь присоединение 2-ой, а затем и 3-ей молекулы кислорода, так же изменяет конформацию и облегчает присоединение следующих молекул кислорода. Сродство гемоглобина к 4-ой молекуле кислорода примерно в 300 раз больше чем к 1-ой.

Модель молекулы гемоглобина.
Кроме кислорода, молекула гемоглобина может быть связана с другими лигандами. Например, при соединении Hb с оксидом углерода (II) (угарный газ СО), образуется карбоксигемоглобин (НвСО). Причем гемоглобин имеет большее сродство к угарному газу чем к кислороду. Поэтому если в воздухе содержится угарный газ, гемоглобин легче с ним связывается и теряет способность связывать кислород. Наступает смерть от удушья, от недостаточного снабжения тканей кислородом.
Возможно образование еще одного производного гемоглобина - карбгемоглобина, когда гемоглобин связывается с СО2. Однако СО2 связывается не с гемом, а присоединяется к NH2 – группам глобина. Образование карбгемоглобина используется для выведения СО2 из тканей к легким. Этим путем выводится 10-15% СО2.
Типы гемоглобинов.
Гемоглобины могут различаться по белковой части. Различают физиологические и аномальные типы гемоглобинов. Физиологические типы образуются на разных этапах нормального развития организма, а аномальные - вследствие нарушения последовательности аминокислот в белке глобине физиологических типов гемоглобина.
Физиологические типы гемоглобинов отличаются друг от друга набором полипептидных цепей или субъединиц, образующихся на разных этапах развития организма человека – от эмбрионального до взрослого состояния. Различаются следующие физиологические типы гемоглобинов:
а) примитивный НвР, появляется на самых ранних стадиях развития эмбриона (1 – 2 недели) Эмбриональный гемоглобин – тетрамер
б) фетальный гемоглобин НвF (от лат. Fetus – плод). НвF является главным типом гемоглобина плода и составляет к моменту рождения 70% всего гемоглобина – это тетрамер (
в) гемоглобин взрослого НвА, НвА2, НвА3 (от лат. Adultus – взрослый). НвА появляется на более поздних стадиях развития плода, в крови взрослого человека примерно 95 – 96% НвА – это тетрамер (2?, 2?). Гемогловин А2 – тетрамер. Его содержание в эритроцитах взрослого человека равно 2%.
Аномальные гемоглобины. Их обнаружено более 200 и отличаются они составом цепей или заменой аминокислот в полипептидных цепях. Из аномальных гемоглобинов часто встречается HвS или серповидно-клеточный Нв. Он обнаруживается у больных серповидно-клеточной анемией. Это широко распространенное заболевание в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. Гемоглобин S отличается по ряду свойств от нормального гемоглобина. После отдачи кислорода в тканях он превращается в плохо растворимую форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов. Последние деформируют клетку и приводят к массивному гемолизу.
Химический дефект при серповидно-клеточной анемии сводится к замене в белке одной аминокислоты на другую. В норме в b - субъединицах тетрамерной структуры гемоглобина в шестом положении со стороны N – конца находится глутаминовая аминокислота, боковая группа которой имеет отрицательный заряд и характеризуется высокой гидрофильностью. При серповидно-клеточной анемии глутаминовая аминокислота заменена на гидрофобную аминокислоту – валин. Однако одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития болезни.
Миоглобин также относится к хромопротеинам. Это белок, имеющий третичную структуру. Вторичная и третичная структура миоглобина и протомеров гемоглобина очень сходны. Функции миоглобина и гемоглобина одинаковы. Оба белка участвуют в транспорте кислорода. Гемоглобин присоединяет кислород из альвеолярного воздуха и доставляет его в ткани. Миоглобин присоединяет кислород, доставленный гемоглобином и служит промежуточным звеном в транспорте кислорода внутри клетки к митохондриям, а также для запасания кислорода в тканях, создавая кислородный резерв, который расходуется по мере необходимости. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в тканях падает, кислород освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения энергии, необходимой для работы мышц.
УГЛЕВОД – БЕЛКОВЫЕ КОМПЛЕКСЫ
Это комплексы белков с небелковой частью, представленной углеводными компонентами.
Смешанные макромолекулы этого типа делятся на:
ГЛИКОПРОТЕИНЫ (ГП)
ПРОТЕОГЛИКАНЫ
ГП - это сложные белки, содержащие олигосахаридные (гликановые) цепи, ковалентно связанные с белковой основой. К этой группе химических соединений относятся многие белки внешней поверхности цитоплазматических мембран и большинство секретируемых белков. ГП могут содержать до 40% углеводов, но как правило, в молекуле преобладает белковая часть.
Короткие углеводные цепи ГП построены из глюкозамина, галактозамина, глюкозы, галактозы. Наиболее значимые моносахариды в составе ГП – N – ацетилглюкозамин, N – ацетилгалактозамин, N – ацетилнейраминовая (сиаловая) кислота.
Число коротких углеводных цепей в ГП может доходить до 300-800. Длина и степень разветвленности углеводных цепей значительно варьирует. В составе одной олигосахаридной цепи находится не более 15-20 моносахаридных остатков. ГП присутствуют во всех классах белков – ферментах, гормонах, транспортных, структурных белках. Представители ГП – коллаген, эластин, иммуноглобулины.
Углеводный компонент, даже небольшой по массе, сообщает качественно новые свойства молекуле белка гликопротеинов. Для гликопротеинов характерна термостабильность, в отличие от простых белков ГП выдерживают высокие и низкие температуры без изменения физико-химических свойств. ГП в отличие от других белков с трудом перевариваются протеолитическими ферментами.
Углеводная часть придает белку большую специфичность. Это своего рода векторные группы сложных белков, «узнающие» участки других структур (макромолекул, поверхности клеток). ГП быстрее выводятся из клетки и находятся, как правило, вне клетки.
Гликопротеины выполняют следующие функции:
1. Функция избирательного взаимодействия высокоспецифического узнавания.
Клеточные ГП, находящиеся на поверхности мембран, участвуют в очень тонких процессах биологического узнавания и межклеточного взаимодействия, выполняя роль рецепторных систем для определенных соединений и клеток.
2. Транспортная роль.
ГП осуществляют транспорт гидрофобных веществ и ионов металлов. Так
функцию переносчика железа выполняет ГП – трансферрин; меди – церуллоплазмин; стероидных гормонов – транскортин.
3. Каталитическая.
Углеводный компонент обнаружен в составе некоторых ферментов: энтерокиназа, пероксидаза, глюкозооксидаза, холинэстераза.
4. Функция защитной смазки.
Гликопротеины являются составными веществами муцинов слюны, желудочного и кишечного муцинов.
5. Участвуют в процессе свертывания крови.
Протромбин, фибриноген – являются белками свертывающей системы крови.
ПРОТЕОГЛИКАНЫ.
Это углевод-белковые комплексы, углеводный компонент которых представлен гетерополисахаридами, построенными из большого числа повторяющихся единиц. В отличие от гликопротеинов, которые содержат только несколько процентов углеводов (по массе), протеогликаны могут содержать до 95 % и более углеводов. Кроме того, по свойствам они ближе к углеводам, чем к белкам. Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы.
В состав протеогликанов входят кислые гетерополисахариды (гликозамингликаны) линейного строения. Они построены из повторяющихся дисахаридных единиц – димеров. Одним из компонентов этих димеров является Д-глюкуроновая кислота.
В составе притеогликанов содержатся следующие гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты, гепарин (строение гетерополисахаридов смотри в разделе 3-4).
Гиалуроновая кислота состоит из повторяющихся единиц (димеров) включающих Д-глюкуроновую кислоту и N-ацетилглюкозамин.
Хондроитинсульфаты содержат структурные единицы из глюкуроновый кислоты и сульфатированного N-ацетилгалактозамина.
Протеогликаны являются обязательными компонентами межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей.
Благодаря особенностям структуры и физико-химическим свойствам протеогликаны выполняют в организме следующие функции:
- являются структурными компонентами межклеточного матрикса;
- являясь поликатионами они могут присоединять, кроме воды большие количества катионов (Na+, K+, Ca2+) и таким образом участвовать в формировании тургора различных тканей;
- протеогликаны играют роль молекулярного сита в межклеточном матриксе и препятствуют распространению патогенных микроорганизмов.
Эта группа полисахаридов представляет собой сильно гидратированные, желеподобные, липкие вещества, имеющие значительный отрицательный заряд. Все они находятся в межклеточном веществе, но не в свободном состоянии, а связаны с белками. Такие смешанные макромолекулы называются протеогликанами, поскольку основные свойства этих макромолекул определяются углеводной, а не белковой частью.
ЛИПИД – БЕЛКОВЫЕ КОМПЛЕКСЫ
Это комплексы белков с липидными компонентами, их условно подразделяют на две группы:
1. Свободные липопротеины.
Липопротеины плазмы крови, молока, растворимы в воде.
2. Структурные протеолипиды.
Входят в состав биомембран, растворимы в жирах.
Липид – белковые комплексы в качестве небелковой части содержат липидные компоненты. Высшие жирные кислоты
| С17 Н35 СООН | Предельная Стеариновая |
| С15 Н31 СООН | Пальмитиновая |
| С17 Н33 СООН | Олеиновая |
| С17 Н31 СООН | Линолевая |
| С17 Н29 СООН | Линоленовая |
| С19Н29СООН | Арахидоновая |
1.Свободные липопротеины.
Содержатся в плазме крови, все они имеют разную плотность (от 0,92 до 1,21 кг/л) благодаря липидному компоненту. В крови человека присутствуют несколько фракций ЛП, отличающихся по плотности, что связазано с различным соотношением липидного и белкового компонента в молекуле.
ФРАКЦИИ ЛП:
А) Хиломикроны (ХМ). Это самая низкая по плотности фракция, т.к. в составе их преобладают липидные комплексы и на долю белка приходится до 2 %. Плотность 0,95 кг/л. Хиломикроны появляются в сыворотке крови после приема жирной пищи;
Б) Липопротеины очень низкой плотности (ЛПОНП). или пре-b-липопротеины, их плотность 0,94 – 1,006 кг/л;
В) Липопротеины низкой плотности (ЛПНП) или b-липопротеины. Плотность их 1,006 – 1,063 кг/л;
Г) Липопротеины высокой плотности (ЛПВП) или a-липопротеины. Плотность их 1,063 – 1,210 кг/л. В составе их преобладает белковый компонент.
РОЛЬ СВОБОДНЫХ (ПЛАЗМЕННЫХ) ЛИПОПРОТЕИНОВ.
Свободные ЛП играют транспортную роль, поэтому их называют - транспортными формами липидов. Благодаря своей растворимости в водной среде они могут переносить липиды, поступающие в кровь при всасывании из кишечника, а также распределять липиды между тканями, одни из которых их синтезируют, а другие используют.
ЛП переносят триацилглицеролы, фосфолипиды, стероиды, а также небольшое количество жирорастворимых витаминов, b-каротина.
В настоящее время доказана роль фракций липопротеинов в патогенезе атеросклероза – они называются атерогенными ЛП. К ним относятся ЛПНП и ЛПОНП, а фракцию ЛПВП называют антиатерогенной, так как её увеличение препятствует развитию атеросклероза.
2.Структурные липопротеины (протеолипиды).
Они входят в состав биологических мембран и растворяются в неполярных растворителях (хлороформ, метанол). Причина такого поведения протеолипидов в том, что белок составляет сердцевину их молекулы, а оболочку образует липидный компонент. Содержание белка в протеолипидах 65 – 85 %. Они обнаружены в сердце, почках, легких, скелетных мышцах. В клетках перечисленных органов они представляют основу биологических мембран, образуя двойной липидный слой, в формировании которого участвуют фосфо- и гликолипиды. Состав протеолипидов в различных органах неодинаков.
Date: 2015-07-24; view: 1720; Нарушение авторских прав