
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота №1
|
|
ЗДОБУВАННЯ КИСЛОТ, ГІДРОКСИДІВ ТА СОЛЕЙ
Мета роботи: повторення матеріалу про загальну характеристику основних класів неорганічних сполук.
1.1 Загальні відомості
1.1.1 Здобування та властивості оксидів
| Здобування | Хімічні властивості |
1. Взаємодія простих речовин з киснем (крім  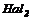 ( (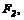 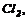 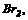 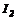 ):
2Са + О2 = 2СаО
Кальций оксид
2. Окиснення деяких складних речовин: ):
2Са + О2 = 2СаО
Кальций оксид
2. Окиснення деяких складних речовин:
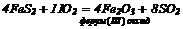 2SO4 + O2 = 2SO3
cульфур (IV) cульфур (VI)
оксид оксид
3. Розкладання оксидів:
4CrO3 = 2Cr2O3 + 3О2
хром(VI) оксид хром(III) оксид
4. Розкладання гідроксидів:
t C
Cu(OH)2 = CuO + H2O
кальцій гідроксид
5. Розкладання кислот:
H2SO3 = SO2 + H2O
сульфатна(IV) сульфур(IV)
кислота оксид
6. Розкладання солей:
СаСО3 = СаО + СО2
Кальций карбонат карбон(IV)оксид
2SO4 + O2 = 2SO3
cульфур (IV) cульфур (VI)
оксид оксид
3. Розкладання оксидів:
4CrO3 = 2Cr2O3 + 3О2
хром(VI) оксид хром(III) оксид
4. Розкладання гідроксидів:
t C
Cu(OH)2 = CuO + H2O
кальцій гідроксид
5. Розкладання кислот:
H2SO3 = SO2 + H2O
сульфатна(IV) сульфур(IV)
кислота оксид
6. Розкладання солей:
СаСО3 = СаО + СО2
Кальций карбонат карбон(IV)оксид
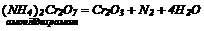 7. Взаємодія кислот-окисників з металами та неметалами:
Cu + 4HNO3 = Cu(NO3)2+ 2NO2 + 2H2O
Нітратна купрум (ІІ) нітроген(ІV)
Кислота нітрат оксид
7. Взаємодія кислот-окисників з металами та неметалами:
Cu + 4HNO3 = Cu(NO3)2+ 2NO2 + 2H2O
Нітратна купрум (ІІ) нітроген(ІV)
Кислота нітрат оксид
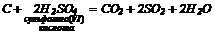 8. Заміщення леткого оксиду менш летким при нагріванні:
8. Заміщення леткого оксиду менш летким при нагріванні:
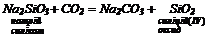
| 1. Взаємодіють з водою з утворенням гідроксидів або кислот:
Na2O + H2O = 2NaOH
Натрій оксид натрій гідроксид
MnO3 + H2O = H2MnO4
Манган(VI) манганатна(ІV)
Оксид кислота
2. Основні оксиди взаємодіють з
кислотними та амфотерними оксидами (при нагріванні):
3MgO + P2O5 = Mg3(PO4)2
Магній Фосфор (V) магный
Оксид оксид ортофосфат
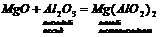 3. Основні та амфотерні оксиди взаємодіють з кислотами:
3. Основні та амфотерні оксиди взаємодіють з кислотами:
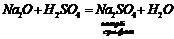 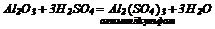 4. Амфотерні та кислотні оксиди взаємодіють з лугами:
4. Амфотерні та кислотні оксиди взаємодіють з лугами:
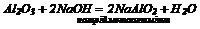
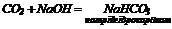
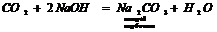 5. Деякі оксиди розкладаються:
5. Деякі оксиди розкладаються:
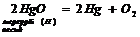
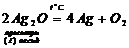
|
1.1.2 Здобування та властивості гідроксидів
| Здобування | Хімічні властивості |
1. Взаємодія активних металів з водою:
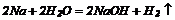
 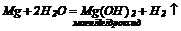 2. Взаємодія оксидів лужних та лужноземельних металів з водою:
2. Взаємодія оксидів лужних та лужноземельних металів з водою:
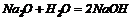
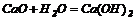 3. Взаємодія розчинів солей з лугами:
3. Взаємодія розчинів солей з лугами:
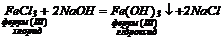 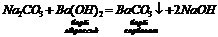 4. Електроліз водних розчинів солей (в розчині в катодному просторі накопичується 4. Електроліз водних розчинів солей (в розчині в катодному просторі накопичується 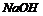 ): ):
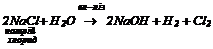 5. У результаті інших реакцій:
5. У результаті інших реакцій:
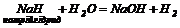
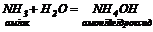
| 1. Гідроксиди лужних та лужно-земельних металів дисоціюють в водних розчинах:
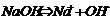
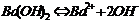 2. Розчини гідроксидів металів та
2. Розчини гідроксидів металів та 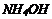 змінюють забарвлення індикаторів (див. додаток A).
3. Взаємодіють з кислотними оксидами та кислотами: змінюють забарвлення індикаторів (див. додаток A).
3. Взаємодіють з кислотними оксидами та кислотами:
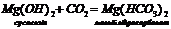
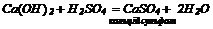 4. Луги взаємодіють з неметалами (
4. Луги взаємодіють з неметалами (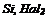 ) та деякими металами ( ) та деякими металами (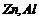 та ін.): та ін.):
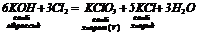 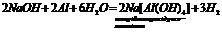 5. Взаємодіють з амфотерними, оксидами та гідроксидами: 5. Взаємодіють з амфотерними, оксидами та гідроксидами:
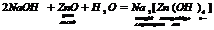 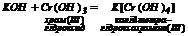
|
1.1.3 Здобування та властивості кислот
| Здобування | Хімічні властивості |
1. Взаємодія кислотних оксидів з водою:

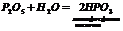 2. Окиснення деяких простих речовин:
2. Окиснення деяких простих речовин:
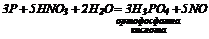 3. Взаємодія солей з кислотами (сильними чи менш леткими, ніж отримувана):
3. Взаємодія солей з кислотами (сильними чи менш леткими, ніж отримувана):
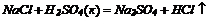 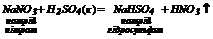 4. Безкисневі кислоти можуть бути отримані безпосередньо з водню та неметалу:
4. Безкисневі кислоти можуть бути отримані безпосередньо з водню та неметалу:
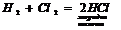
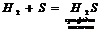 Водні розчини таких сполук є кислотами.
5. Гідроліз галогенангідридів:
Водні розчини таких сполук є кислотами.
5. Гідроліз галогенангідридів:
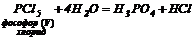
| 1. В розчинах дисоціюють

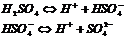 2. Розчини кислот змінюють забарвлення індикаторів (див. додаток A)
3. Кислоти – неокисники, реагують з металами, які стоять в ряду стандартних електродних потенціалів до водню, їх
2. Розчини кислот змінюють забарвлення індикаторів (див. додаток A)
3. Кислоти – неокисники, реагують з металами, які стоять в ряду стандартних електродних потенціалів до водню, їх 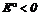 : :
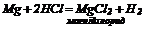 4. Кислоти - окисники реагують майже з усіма металами, при цьому водень не виділяється:
4. Кислоти - окисники реагують майже з усіма металами, при цьому водень не виділяється:
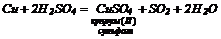 5. Взаємодіють з оксидами та гідроксидами металів:
5. Взаємодіють з оксидами та гідроксидами металів:
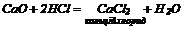
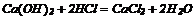 6. Реагують з солями, якщо утворюються слабкі електроліти:
6. Реагують з солями, якщо утворюються слабкі електроліти:

|
1.1.4 Здобування та властивості солей
| Здобування | Хімічні властивості |
1. Взаємодія металів та неметалів:
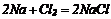 2. Взаємодія металів з кислотами:
2. Взаємодія металів з кислотами:
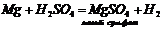
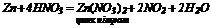 3. Взаємодія основних та кислотних оксидів:
3. Взаємодія основних та кислотних оксидів:
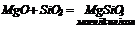 4. Взаємодія основних та амфотерних оксидів з кислотами:
4. Взаємодія основних та амфотерних оксидів з кислотами:
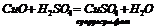 5. Взаємодія гідроксидів з кислотними оксидами:
5. Взаємодія гідроксидів з кислотними оксидами:
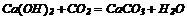 6. Взаємодія гідроксидів з кислотами:
6. Взаємодія гідроксидів з кислотами:
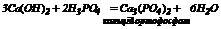
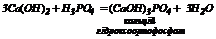 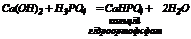 7. Взаємодія металів з розчинами солей:
7. Взаємодія металів з розчинами солей:
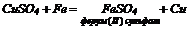 8. Взаємодія кислот з солями:
8. Взаємодія кислот з солями:
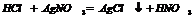 9. Взаємодія двох солей:
9. Взаємодія двох солей:
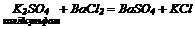 10. Взаємодія лугів з амфотерними металами, оксидами, та гідроксидами:
10. Взаємодія лугів з амфотерними металами, оксидами, та гідроксидами:
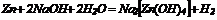 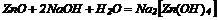 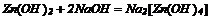
| 1. Розчинні у воді солі, утворені сильними гідроксидами та сильними кислотами, дисоціюють за схемою:
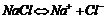 Розчинні у воді солі, утворені слабкими гідроксидами та (або) слабкими кислотами, гідролізують:
Розчинні у воді солі, утворені слабкими гідроксидами та (або) слабкими кислотами, гідролізують:
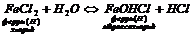
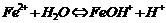
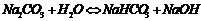
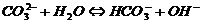 2. Розчини солей реагують з металами, що мають менше значення
2. Розчини солей реагують з металами, що мають менше значення 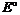 (стандартний електродний потенціал), ніж метал, що утворює катіон солі: (стандартний електродний потенціал), ніж метал, що утворює катіон солі:
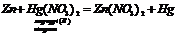 3. Розчини солей взаємодіють з лугами:
3. Розчини солей взаємодіють з лугами:
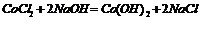 4. Взаємодіють з кислотами:
4. Взаємодіють з кислотами:
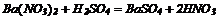 5. Розчини солей реагують між собою, якщо утворюються слабкі електроліти: 5. Розчини солей реагують між собою, якщо утворюються слабкі електроліти:
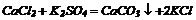 6. Деякі солі розкладаються при нагріванні:
6. Деякі солі розкладаються при нагріванні:
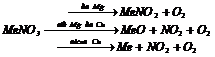
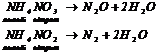
|
1.2 Завдання для самостійного розв’язання:
| Варіант | Скласти рівняння реакцій * | Скласти графічні формули | ||
| здобування речовин | хімічних властивостей | взаємних перетворень | ||
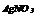
| 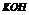
| 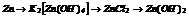
| 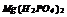
| |
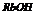
| 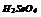
| 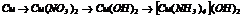
| 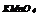
| |
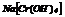
| 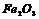
| 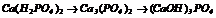
| 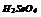
| |
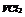
| 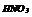
| 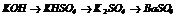
| 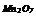
| |
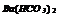
| 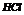
| 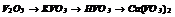
| 
| |
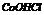
| 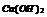
| 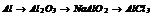
| 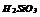
| |
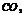
| 
| 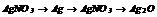
| 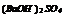
| |
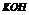
| 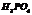
| 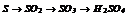
| 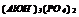
| |
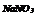
| 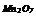
| 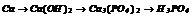
| 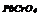
| |
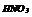
| 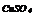
| 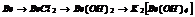
| 
| |
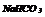
| 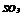
| 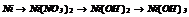
| 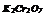
| |
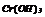
| 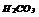
| 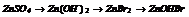
| 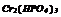
| |
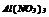
| 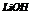
| 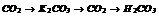
| 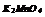
| |
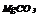
| 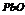
| 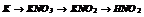
| 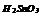
| |
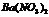
| 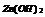
| 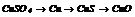
| 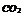
| |
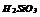
| 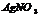
| 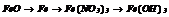
| 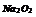
| |
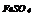
| 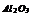
| 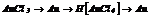
| 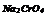
| |
| Cuo | 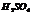
| 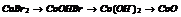
| 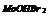
| |
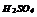
| 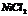
| 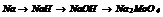
| 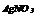
| |
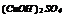
| 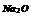
| 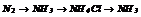
| 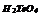
| |
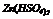
| 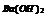
| 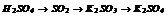
| 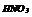
| |
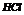
| 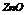
| 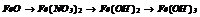
| 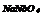
| |
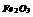
| 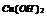
| 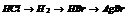
| 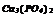
| |
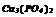
| 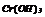
| 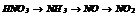
| 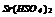
| |
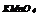
| 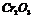
| 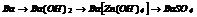
| 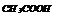
|
*в молекулярному та йонному вигляді, дати назви всім речовинам
Date: 2015-07-23; view: 754; Нарушение авторских прав