
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Диаграмма фазового равновесия
|
|
Основными методами, используемыми для построения диаграмм состояния, являются: термический, микроструктурный и рентгеноструктурный методы. К числу дополнительных методов относятся дюрометрический, включающий исследование микротвердости структурных составляющих, механических свойств, определение электропроводности, теплопроводности, дилатометрический и магнитный методы, а также применение радиоактивных изотопов.
Наиболее наглядным и простым методом построения диаграмм состояния является термический метод, заключающийся в исследовании кинетических кривых охлаждения сплавов различных составов. Наблюдая по пирометру изменение температуры при медленном охлаждении металла, и откладывая на графике это снижение температуры в зависимости от времени, получают серии кривых для каждого из сплавов исследуемых систем (рисунок 3.2).
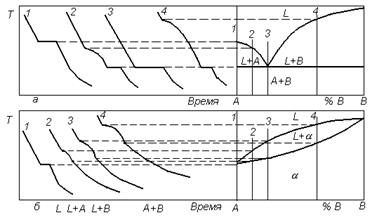
|
| Рисунок 3.2. Построение диаграмм фазового равновесия с применением термического анализа: а – в системе без растворимости компонентов в твердом состоянии; б – с непрерывным рядом твердых и жидких растворов; 1-4- номера сплавов и соответствующие им термические кривые для разных типов диаграмм |
Существование горизонтальной площадки на кривой охлаждения чистого металла при его затвердевании или аллотропическом превращении вытекает из правила фаз, поскольку вариантность системы при этом С = 0. Такую же площадку имеет кривая и при протекании эвтектического превращения (рисунок 3.2, а). На термических кривых кристаллизации сплавов 2 и 4 перед горизонтальными участками наблюдается изменение наклона кривых охлаждения, что соответствует выпадению кристаллов компонентов А или В из жидкой фазы, происходящему в интервале температур. В системе с непрерывным рядом жидких и твердых растворов (рисунок 3.2, б) все термические кривые сплавов (за исключением чистых компонентов) однотипны. Кристаллизация всех сплавов полностью происходит в интервале температур. Следовательно, по правилу фаз вариантность в этих случаях равна С = 2 + 1 - 2 = 1, где в равновесии находятся две фазы во всем температурном интервале кристаллизации избыточных компонентов (А + L) или (В + L) (рисунок 3.2,а), или твердого раствора (L + a) (рисунок 3.2, б).
Для построения диаграммы фазового равновесия обнаруженные на термических кривых критические точки (точки перегиба, температуры ступенек) наносят на диаграммное поле в координатах состав - температура и соединяют их плавными кривыми.
Кривые, разграничивающие жидкое состояние сплава от твердо-жидкого и являющиеся линиями начала кристаллизации, называют линиями ликвидуса. Выше этих линий сплавы находятся в жидком состоянии. Линии, ниже которых сплавы находятся в твердом состоянии, называются линиями солидуса.
Построенные с помощью термического метода диаграммы уточняются различными методами металлографического исследования и измерениями физико-механических свойств сплавов, составляющую данную систему. Диаграммы состояния дают в сжатой и наглядной форме картину строения и свойств сплава при изменении его концентрации и температуры, позволяют определить температуру плавления, затвердевания и аллотропических превращений в сплавах, дают возможность изучить происхождение структур, наблюдаемых под микроскопом и увязать их структуру с механическими технологическими и физико-химическими свойствами. При изыскании новых сплавов диаграммы позволяют заменить старый рецептурный метод новым, научным методом, при помощи которого можно скорее и лучше подобрать их оптимальный состав.
Практическим недостатком диаграмм состояния (диаграмм фазового равновесия) является то, что они не содержат фактора времени и соответствуют только условиям равновесия, т.е. условиям очень медленного нагрева и охлаждения. В производственных условиях применяют большие скорости охлаждения, при которых критические точки резко изменяют свое положение, а в ряде случаев могут изменяться даже формы фазовых переходов.
Date: 2015-07-11; view: 413; Нарушение авторских прав