
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамические основы процесса кристаллизации
|
|
Кристаллизация может происходить как при переходе из жидкого состояния в твердое, так и в твердом состоянии при переходе из одной аллотропической формы в другую. Во втором случае такое превращение носит название фазовая перекристаллизация.
Процесс кристаллизации состоит из следующих двух стадий:
1) образование центров кристаллизации (зародышей),
2) рост кристаллов вокруг этих центров.
Основной причиной и движущей силой процесса кристаллизации является стремление вещества к наиболее устойчивому в термодинамическом отношении, состоянию, т.е. к наименьшему запасу свободной энергии (рисунок 2.1).
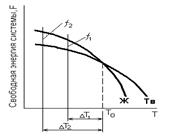
| Рисунок 2.1. Зависимость изменения свободной энергии системы жидкой и твердой фаз от температуры |
При наличии фазового перехода из твердого в жидкое состояние, и наоборот, эти кривые должны пересекаться. Точка пересечения соответствует равенству свободных энергий твердой и жидкой фазы, что говорит о возможности сосуществования в металле при данных условиях как твердых, так и жидких фаз. Физический смысл температуры Т0, при которой наблюдается равенство свободных энергий твердой и жидкой фазы выражается как температура фазового равновесия: плавление-кристаллизация.
При температуре Т1 > Т0 запас свободной энергии жидкой фазы меньше, чем твердой. В этих условиях устойчивой фазой будет жидкость. При понижении температуры ниже Т0 меньшей энергией обладает твердая фаза, которая и становится стабильной в данных условиях. Однако изучение кривых охлаждения реальных металлов показывает, что затвердевание начинается не при температуре Т0 , а при ТS < Т0 (рисунок 2.2).
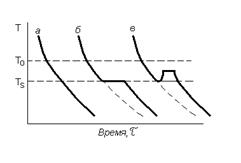
| Рисунок 2.2. Термические кривые затвердевания: а - аморфного вещества; б, в - кристаллического при различных тепловых эффектах кристаллизации |
Это объясняется тем, что при образовании новой фазы должна появиться граница между двумя фазами, на что расходуется часть свободной энергии системы. В некоторых случаях для образования первых зародышей новой фазы, первых межфазных границ требуется очень значительные затраты энергии, а для образования последующих частиц затраты энергии меньше. В этом случае кривые охлаждения будут иметь вид кривой (в).
Остановка в понижении температуры связана с выделением при кристаллизации скрытой теплоты превращения. В некоторых случаях выделение теплоты при кристаллизации настолько велико, что температура поднимается несколько выше температуры ТS. Температура ТS носит название температуры затвердевания, разность температур Т0 - ТS носит название степени переохлаждения.
Необходимость переохлаждения при кристаллизации обусловлена рядом причин. Затвердевание жидкости начинается с образования зародышей очень малых размеров, и приводит к образованию межфазной границы между жидкой и твердой фазами. Такая граница на начальном этапе кристаллизации характеризуется очень большой относительной протяженностью по отношению к объему формирующихся кристаллов. При этом, известно, что любая граница является своеобразным дефектом кристаллического строения, а, следовательно, обладающей более высоким уровнем свободной энергии по сравнению со свободной энергией жидкости и твердой фазы.
Таким образом, образование границы - поверхности раздела требует затраты свободной энергии в количестве прямо пропорциональном удельной величине поверхностного натяжения на границе раздела фаз (s) и протяженности поверхности твердой частицы (S), т.е.
S × s = 4pr2 × s
Поскольку процессы, протекающие с увеличением свободной энергии, не могут происходить самопроизвольно, то при температуре Т0 появление стабильных кристаллов оказывается невозможным.
Наличие флуктуаций энергии, однако, приводит к непрерывному появлению и исчезновению твердой фазы таким образом, что суммарная энергия системы не изменяется и процесс кристаллизации не происходит.
При понижении температуры может происходить уменьшение свободной энергии системы на величину DF, пропорциональную удельной энергии превращения и объему твердой частицы -  . Таким образом, суммарная величина свободной энергии системы при кристаллизации равна
. Таким образом, суммарная величина свободной энергии системы при кристаллизации равна  . Графическое выражение этого уравнения дает следующую картину (рисунок 2.3).
. Графическое выражение этого уравнения дает следующую картину (рисунок 2.3).
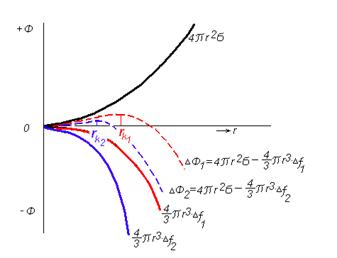
| Рисунок 2.3. Изменение суммарной энергии системы и ее составляющих при кристаллизации в зависимости от размера образующегося зародыша и степени переохлаждения: индексы -1 соответствуют малой степени переохлаждения; 2 - более высокой степени переохлаждения |
Здесь штриховые линии являются геометрической суммой объемной и поверхностной энергии - функцией изменения величины полной свободной энергии системы. Из приведенного рисунка видно, что самопроизвольный процесс оказывается невозможным до тех пор, пока размер кристалла твердой фазы не достигнет размера rк названного критическим зародышем. Таким образом переохлаждение DТ = Т0 - ТS должно быть таким, чтобы разница свободных энергий f = Fж - Fтв обеспечивала бы появление в системе запаса свободной энергии, достаточной для образования критического зародыша.
После образования зародыша критического размера, присоединение к твердым кристаллам новых атомов приводит к значительному увеличению отрицательного члена уравнения, превышающего рост поверхностной энергии, в связи с чем увеличение объема твердой фазы приводит к непрерывному уменьшению свободной энергии системы, процесс кристаллизации продолжается самопроизвольно. Самопроизвольно процесс может развиваться лишь в том случае, если размер образовавшихся частиц больше критического.
Date: 2015-07-11; view: 406; Нарушение авторских прав