
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Схема 16. Схема патогенеза болезни Иценко-Кушинга
|
|
1 – серотонинергические и 2 – ацетилхолинергические нейроны, стимулирующие синтез кортиколиберина; 3 – норадреналинергический нейрон, ингибирующий синтез кортиколиберина.
Клиническая картина. Болезнь Иценко-Кушинга обусловлена избыточной секрецией кортикостероидов и в первую очередь глюкокортикоидов. Как отмечалось, заболевание в 4-5 раз чаще встречается у женщин и наиболее часто его начало приходится на возраст 25-45 лет. Основными клиническими признаками являются центральное (туловищное) ожирение, розово-пурпурные стрии, акне и “нечистота” кожных покровов, экхимозы, избыточное оволосение, гирсутизм, артериальная гипертензия, полиурия, нарушения менструального цикла, мышечная слабость, особенно выражена в проксимальных мышцах конечностей, изменения психики, остеопороз и даже патологические переломы ребер, позвоночника и реже конечностей. У детей и подростков болезнь Иценко-Кушинга наряду с вышеперечисленными признаками сопровождается задержкой роста.
В большинстве случаев заболевание начинается с ожирения, причем происходит характерное перераспределение подкожного жирового слоя: в основном наблюдается отложение жира в области плечевого пояса, живота, надключичных пространств, лица, молочных желез и спины (область VII шейного позвонка-“климактерический горбик”, или “буйволовый тип”). Лицо становится лунообразным, круглым, щеки – красными. Все это создает характерный вид лица – ”матронизм” (рис. 9).
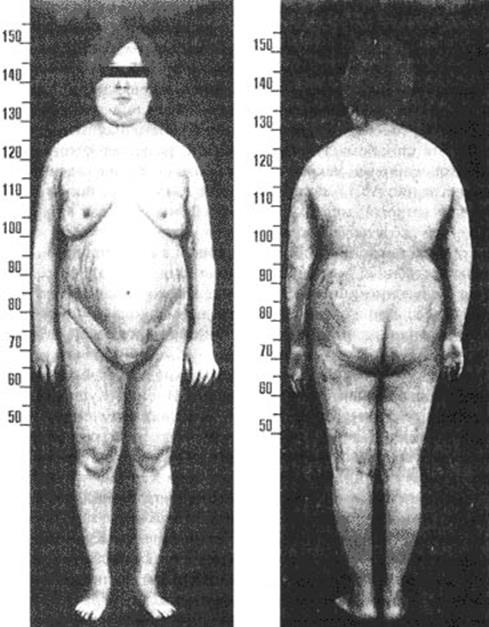
Рис 9. Внешний вид больной, страдающей болезнью Иценко-Кушинга.
Ожирение, наблюдаемое почти у 95% больных, связано с гиперсекрецией кортизола, который способствует повышению аппетита, путем усиления глюконеогенеза увеличивает образование глюкозы, необходимой для синтеза жиров. Повышение секреции инсулина стимулирует липогенез. В то же время периферическая утилизация глюкозы при избытке кортизола уменьшается. Неясен механизм перераспределения подкожной жировой клетчатки, но большинство авторов считают, что этот процесс также обусловлен повышенным количеством кортикостероидов.
На коже живота, подмышечной области, плечевого пояса, бедер и ягодиц появляются своеобразные полосы – стрии различной окраски (от цианотичной до багрово-красной) длиной до 8 см и шириной до 2 см. Эти стрии отличаются от бледных или слегка розоватых полос растяжения, которые встречаются при ожирении, особенно у девушек, в период беременности или после родов и являются результатом растяжения кожи от избыточного отложения жира. При болезни Иценко-Кушинга появление стрий связано с нарушением белкового обмена (катаболизм белков), в результате чего кожа истончена и легко ранима, а различные ее повреждения и раны длительно не заживают. Цвет стрий обусловлен сосудами, расположенными под собственно кожей. Наблюдаемая при этом заболевании полицитемия также оказывает влияние на цвет стрий. Кожа истончается вследствие атрофии эпидермиса и соединительной ткани. Частое наличие гематом и экхимозов при незначительных травмах и даже без видимых травм является следствием истончения кожи и повышенной ломкости капилляров. Даже простая процедура – взятие крови из локтевой вены для лабораторных исследований сопровождается значительными экхимозами. Любые раны медленно заживают, что, естественно, является источником различных послеоперационных осложнений. Часто встречается отек нижних конечностей, который является не следствием сердечной недостаточности, а результатом повышенной проницаемости капилляров. Изредка встречаются спонтанные разрывы, главным образом сухожилий.
Наряду с этим отмечается гиперпигментация кожных покровов, особенно в местах трения кожи (шея, локти, живот). Считается, что избыточное отложение меланина в коже является результатом повышенной секреции АКТГ и b-липотропина, а возможно, и b-МСГ. Гиперпигментация при болезни Иценко-Кушинга не так резко выражена, как при болезни Аддисона и синдроме Нельсона. Это связано с тем, что при болезни Иценко-Кушинга аденома гипофиза не является абсолютно автономной и секреция АКТГ у этих больных угнетается избытком кортизола, секретируемого надпочечниками.
После адреналэктомии секреция АКТГ может увеличиваться значительно, приводя к развитию синдрома Нельсона в тех случаях, когда проводится недостаточная заместительная терапия глюкокортикоидами или если доза экзогенных кортикостероидов достаточна для поддержания нормальной жизнедеятельности организма и обмена веществ, но недостаточна для ингибирования по принципу обратной связи избыточной секреции АКТГ (снижение чувствительности гипоталамических и гипофизарных центров к глюкокортикоидам). Синдром Нельсона развивается у 5-8% больных, подвергшихся адреналэктомии. Избыточная гиперпигментация характерна для синдрома Иценко-Кушинга, развитие которого связано с опухолями, способными секретировать большое количество АКТГ и которые носят название АКТГ-продуцирующие опухоли. К таким опухолям относятся: рак легкого (мелкоклеточный, бронхогенный карциноид), рак поджелудочной железы (панкреатическая кистоаденома, злокачественная опухоль островков, карциноид), медуллярный рак щитовидной железы, тимома (злокачественная опухоль или карциноид тимуса), феохромоцитома, карциноид желудочно-кишечного тракта. Около 75% всех случаев АКТГ-эктопированного синдрома приходится на мелкоклеточный рак легких, бронхогенный, панкреатический и карциноид вилочковой железы.
Гирсутизм – избыточное оволосение у женщин; рост усов, бороды, оволосение на груди и лобке по мужскому типу. Незначительное оволосение, которое более характерно для болезни Иценко-Кушинга, обусловлено умеренным повышением образования андрогенов гиперплазированной корой надпочечников, тогда как значительное – избытком андрогенов, образование которых резко увеличено при опухолях надпочечника и других опухолях, секретирующих андрогены (опухоли яичников и др). Истинный вирилизм (значительное оволосение на лице и туловище, выпадение волос на голове, вплоть до появления “лысины”, низкий тембр голоса и гипертрофия клитора) характерен не для болезни Иценко-Кушинга, а для опухоли (часто злокачественной) коры надпочечника. Избыток андрогенов и кортизола приводит к угнетению гонадотропной функции гипофиза, что сопровождается нарушением половой функции.
Остеопороз – один из постоянных признаков заболевания, являющийся причиной болей в позвоночнике, костях. Остеопороз в ряде случаев приводит к спонтанным переломам ребер, позвонков и реже длинных трубчатых костей. Тяжелые формы остеопороза сопровождаются снижением высоты тел позвонков и уменьшением роста больного, нередко снижение роста больного достигает 10-15 см и иногда до 20 см. Так, в нашей практике известен случай, когда больная с достаточно выраженными клиническими признаками болезни Иценко-Кушинга и наличием основной жалобы на снижение роста (около 20 см) была расценена врачом поликлиники как больная с нарушением психики (врач считала, что рост у половозрелого человека не может уменьшаться) и в связи с этим помещена в психиатрическое отделение больницы. В детском возрасте, как отмечено выше, болезнь сопровождается задержкой роста. Рентгенологически остеопороз выявляется более чем у 90% обследованных и варьирует от небольшого остеопороза спинки турецкого седла, костей свода черепа, грудного и поясничного отделов позвоночника с исчезновением костной структуры позвонков (“ватные”, “стеклянные”,”прозрачные” позвонки) до резко выраженного остеопороза с деформацией тел позвонков (“рыбьи”, двояковогнутые позвонки), поражением костей лицевого черепа и трубчатых костей. Наблюдаемая гиперкальциурия при болезни Иценко-Кушинга является следствием остеопороза. Обнаруживаемая в 10-14% случаев при болезни Иценко-Кушинга почечнокаменная болезнь обусловлена нарушением кальциевого, а правильнее фосфорно-кальциевого обмена.
Изменения в костной ткани при болезни Иценко-Кушинга связаны с гиперкортицизмом. Катаболическое действие глюкокортикоидов приводит к уменьшению белковой матрицы кости, снижается содержание в кости органического вещества и его компонентов (коллаген и мукополисахариды). Уменьшая синтез коллагена и тем самым образование матрицы костной ткани, кортизол стимулирует резорбцию кальция из кости. Наряду с этим снижается всасывание кальция в кишечнике и увеличивается его потеря с мочой (гиперкальциурия). Кроме того, кортизол оказывает влияние на кальциевый обмен через угнетение конверсии в почках 25-гидроксивитамина D в 1,25 – дигидроксивитамин D, который является более активным тканевым метаболитом или биологически активным витамином D.
Одним из постоянных признаков болезни Иценко-Кушинга является артериальная гипертензия, обычно умеренная, но нередко протекающая с повышением систолического давления до 220-225 мм рт. ст. и диастолического до 130-145 мм рт. ст. Задержка натрия, вызванная избытком кортизола, является одной из причин гипертензии. Наряду с кортизолом сользадерживающим свойством обладают 11-дезоксикортизол (вещество S), кортикостерон и дезоксикортикостерон, секреция которых также повышается под влиянием АКТГ. На периферические сосуды кортикостероиды оказывают синергическое с катехоламинами влияние. Повышая уровень натрия в организме и содержание воды в стенках артериол с одновременным уменьшением их просвета, кортикостероиды приводят к гипертензии, которая при длительном течении способствует гипертрофии левого желудочка и развитию сердечной недостаточности, нарушений сердечного ритма. Потеря калия мышечными клетками вызывает изменение сосудистой реактивности и повышение сосудистого тонуса. Роль альдостерона в нарушении натрий-калиевого обмена в организме при болезни Иценко-Кушинга незначительна.
Одна из постоянных жалоб лиц, страдающих болезнью Иценко-Кушинга, – мышечная слабость, которая развивается вследствие гипокалиемии, а также катаболического и антианаболического влияния глюкокортикоидов, что проявляется снижением количества аминокислот в мышцах и уменьшением включения меченых аминокислот в белки мышц. Распад белка в мышцах сопровождается повышением уровня аминокислот в крови и увеличением глюконеогенеза в печени. Атрофия мышечной ткани в наибольшей степени выражена в области проксимального отдела плечевого пояса и нижних конечностей, что еще больше усиливает впечатление перераспределения подкожной жировой клетчатки. Атрофия мышц передней брюшной стенки ведет к увеличению живота. Мышечная слабость иногда бывает настолько выраженной (миопатия), что больные без посторонней помощи не могут встать со стула.
Нарушение менструального цикла – один из ранних симптомов болезни Иценко-Кушинга, проявляющийся опсо-, олиго- или аменореей, которая встречается у 70-80% больных, довольно часто встречается бесплодие. В 70% случаев нарушение менструального цикла является одним из первых признаков заболевания. Нередко к этим нарушениям присоединяются гипертрихоз и гирсутизм. При гинекологическом обследовании выявляются трофические изменения наружных половых органов: гиперемия и цианоз слизистых оболочек, гипотрофия матки. При гистологическом исследовании яичников обнаруживаются явления склерозирования белочной оболочки, истончение коркового слоя, гибель фолликулярного аппарата, главным образом на уровне примордиальных фолликулов. Выявляются изменения слизистой оболочки матки: атрофия функционального слоя, кистозное разрастание и уменьшение числа желез.
Изучение секреции гонадотропинов у женщин, страдающих болезнью Иценко-Кушинга, показало, что базальный уровень ЛГ в сыворотке крови больных был значительно снижен, причем на отмечалось соответствующего повышения секреции ЛГ в ответ на введение гонадолиберина. В то же время нарушение секреции ФСГ у этих больных не обнаружено. У некоторых больных одновременно может выявляться гиперпролактинемия.
Аменорея при болезни Иценко-Кушинга является, вероятно, следствием угнетения секреции гонадотропинов избыточным уровнем глюкокортикоидов и андрогенов, а также результатом прямого влияния андрогенов на слизистую оболочку матки.
Беременность, если и возникает, заканчивается самопроизвольным абортом или патологическими родами.
У мужчин, страдающих болезнью Иценко-Кушинга, отмечается снижение либидо и потенции. Уровень тестостерона в сыворотке крови значительно снижен, не компенсируется повышенным образованием надпочечниковых андрогенов. Уменьшение содержания тестостерона в сыворотке крови связано с прямым влиянием на клетки Лейдига избытка кортизола, который угнетает их ответ на действие ЛГ. В ответ на стимуляцию гонадолиберином обнаруживается низкий уровень тестостерона, ФСГ и ЛГ в сыворотке крови у мужчин, страдающих болезнью Иценко-Кушинга. Секреция ФСГ и ЛГ в ответ на внутривенное введение гонадолиберина также снижается. После лечения у большинства больных уровень тестостерона и гонадотропинов в сыворотке крови возвращается к норме.
Таким образом, явления гипогонадизма при болезни Иценко-Кушинга, с одной стороны, являются следствием гиперкортицизма, а с другой – снижения секреции ЛГ, ФСГ, что обусловлено не только нарушением функции гипоталамуса, но и повышенным содержанием глюкокортикоидов в крови.
При болезни Иценко-Кушинга вследствие избытка глюкокортикоидов часто нарушается обмен углеводов. Угнетая утилизацию глюкозы на периферии и повышая глюконеогенез, глюкокортикоиды способствуют развитию гипергликемии. Нарушенная толерантность к глюкоза, по данным многочисленных наблюдений, выявляется у 20-90% обследованных, а явный сахарный диабет – у 15-35% больных. Так называемый стероидный диабет имеет, как правило, благоприятное течение, редко осложняется кетоацидозом; для компенсации углеводного обмена достаточно назначения соответствующей диеты и пероральных сахароснижающих препаратов. Несмотря на гипергликемию, уровень инсулина в сыворотке крови также повышен. Снижение чувствительности к инсулину у лиц, страдающих болезнью Иценко-Кушинга, по-видимому, связано с уменьшением количества рецепторов к инсулину.
У части больных заболевание протекает с нарушениями психической деятельности: наблюдаются эйфория, расстройства сна или депрессивные состояния, раздражительность, эмоциональная неустойчивость и иногда психозы. Депрессия при болезни Иценко-Кушинга, да и при других видах гиперкортицизма, носит перемежающий характер и, как правило, проявляется более выраженно при повышении массы тела. В некоторых случаях депрессия, раздражительность и потеря либидо являются наиболее ранними симптомами, когда еще отсутствуют другие физические симптомы и увеличение массы тела. Частота и степень выраженности этих нарушений не коррелирует со степенью гиперкортицизма. Нередко больные совершают суицидальные попытки и впервые госпитализируются в психиатрические больницы. Нарушение психической деятельности связано с нарушением образования b-эндорфинов и, возможно, других пептидов, а также с тем, что глюкокортикоиды влияют на ряд ферментов, локализованных в клетках ЦНС (глицеролфосфатдегидрогеназа, триптофангидроксилаза и митохондриальная НАДФ-оксидаза). Считается, что избыток глюкокортикоидов усиливает те состояния активности ЦНС, которые имели место на момент развития гиперкортицизма. Таким образом, гиперкортизолемия в развитии депрессии и других психических нарушений отражает нарушения различных областей ЦНС (гипоталамус и области, расположенные выше). Однако патофизиологический механизм этих проявлений пока полностью не ясен.
У некоторых больных выявляются изменения функции почек, сопровождающиеся альбуминурией, гематурией, цилиндрурией и снижением концентрационной способности почек. Мочекаменная болезнь связана, как отмечалось выше, с развитием остеопороза костей и выделением с мочой избытка фосфатов, кальция, что приводит к образованию фосфатных и оксалатных камней. Реже встречаются периферические отеки, полиурия и никтурия при отсутствии глюкозурии и выраженной гипокалиемии.
Имеющаяся у многих больных тенденция к развитию экзофтальма является следствием накопления жира в ретроорбитальной клетчатке и не имеет ничего общего с аутоиммунной офтальмопатией, часто встречающейся у больных с диффузным токсическим зобом. Довольно часто, особенно при макроаденомах гипофиза, больные предъявляют жалобы на головные боли, нарушения зрения.
При болезни Иценко-Кушинга нередко наблюдаются изменения периферической крови: снижение количества лимфоцитов и эозинофилов, повышение количества гранулоцитов. Изменения в свертывающей системе крови протекают по типу тромбогеморрагического синдрома. Отмечаются полицитемия и повышение содержания гемоглобина, что объясняется влиянием повышенного уровня андрогенов.
Болезнь Иценко-Кушинга сопровождается снижением резистентности к инфекциям и, если не проводится лечение, около 50% больных умирают от интеркуррентных инфекций.
Диагноз и дифференциальная диагностика. Диагноз болезни Иценко-Кушинга основывается на клиической картине и результатах лабораторного обследования. Со стороны крови обнаруживаются полицитемия, лимфоцитопения, эозинопения и нейтрофильный лейкоцитоз. Электролиты сыворотки крови часто в предалах нормы, за исключением калия, содержание которого в сыворотке крови снижено, а в тяжелых случаях наблюдается гипокалиемический алкалоз и гипернатриемия.
Рентгенологическое обследование выявляет остеопороз костей скелета. Увеличение резмеров турецкого седла на рентгенограммах встречается относительно редко. Микроаденома, наличие которой характерно для болезни Иценко-Кушинга, выявляется при исследовании с помощью компьютерной томографии (КТ) или томографии с использованием магнитно-ядерного резонанса (МР-томография). Структура костной ткани на МР-томограммах не выявляется, однако сосуды головного мозга, перекрест зрительных нервов и кавернозные синусы хорошо идентифицируются. Микроаденомы, как правило, выявляются ниже диафрагмы турецкого седла, характеризуются умеренной плотностью и, по данным различных авторов, их наличие подтверждается в 50-60% случаев болезни Иценко – Кушинга.
Таким образом, почти у половины больных, страдающих болезнью Иценко-Кушинга, наличие аденомы гипофиза не подтверждается при использовании самых современных диагностических процедур: КТ и МР-томографии. Как отмечалось выше, клинически и по данным биохимического и гормонального обследования больные с болезнью Иценко-Кушиннга при наличии аденомы гипофиза или при ее отсутствии никак не отличаются друг от друга. Некоторые диагностические критерии этих форм заболевания разработаны R. Comtois и соавт. (1993). Изучая секрецию пролактина в ответ на стимуляцию тиролиберином и гонадолиберином (болюсно внутривенно вводится 400 мкг тиролиберина и 100 мкг гонадолиберина), показано, что больные, страдающие болезнью Иценко-Кушинга без наличия аденомы гипофиза (исследования проводились с использованием КТ), имеют достоверно повышенную секрецию пролактина по сравнению с группой больных, у которых наличие аденомы гипофиза было подтверждено соответстующим исследованием. Это четко указывает на различие этиологии и патогенеза двух форм болезни Иценко-Кушинга.
Учитывая, что идентичная клиническая картина болезни может быть обусловлена в таких случаях АКТГ-эктопированным синдромом, необходимо провести МР-томографическое исследование грудной клетки, области живота. Описаны наблюдения, когда при АКТГ-эктопированном синдроме с помощью КТ- или МР-томографии в области гипофиза были выявлены пролактинома или “неактивные” нефункционирующие аденомы гипофиза (инсиденталомы).
Подтверждает диагноз болезни Иценко-Кушинга выявление повышенной секреции АКТГ и кортикостероидов. При определении АКТГ радиоиммунологическим методом обнаруживается умеренное (до 200-300 пг/мл), а при аденоме гипофиза значительное (500-800 пг/мл при норме 20-90, по некоторым данным, до 160 пг/мл; используется для исследования экстрагированная или неэкстрагированная плазма) повышение уровня АКТГ. В последние годы разработаны новые высокочувствительные методы определения АКТГ – иммуннорадиометрическое исследование или IRMA, c чувствительностью 1 пг/мл.
При болезни Иценко-Кушинга не только повышается секреция АКТГ, но изменяется суточный ее ритм. Уровень АКТГ в плазме крови остается повышенным на протяжении 24 часов.
Помимо АКТГ, в плазме крови больных, страдающих болезнью Иценко-Кушинга, определяются другие пептиды, производные ПОМК. К ним относятся: N-терминальный фрагмент, соединительный пептид, b-эндорфин, b- и g- липотрофин, которые секретируются вместе с АКТГ. Несмотря на то, что все перечисленные пептиды определяются в плазме наряду с АКТГ, практическое значение имеет определение b- и g-липотрофина. Эти пептиды более стабильны по сравнению с молекулой АКТГ, и их уровень в плазме практически не изменяется даже при хранении ее при комнатной температуре. Содержание липотрофина в плазме крови повышено при болезни Иценко-Кушинга и этот показатель используется для дифференциальной диагностики опухоли надпочечника или АКТГ-эктопированного синдрома, при которых их уровень в норме или даже снижен (ингибирование гипофиза высоким уровнем кортизола).
Содержание кортизола в сыворотке крови у лиц, страдающих болезнью Иценко-Кушинга, повышено. В норме концентрация кортизола в утренние часы достигает 0,28-0,41 мкмоль/л (10-15 мкг/100 мл), иногда 0,69 мкмоль/л (25 мкг/100мл), а вечером 55-221 нмоль/л (2-8 мкг/100 мл), т.е. утром уровень кортизола в 2-5 раз превышает его содержание в вечерние часы. При болезни Иценко-Кушинга нарушается суточный ритм его секреции, т.е. утрачивается разница между содержанием кортизола в крови в утренние и вечерние часы. Для более точной оценки нарушения ритма секреции кортизола предложена методика, заключающаяся в 6-кратном определении уровня кортизола в течение суток с последующей математической обработкой данных, что позволяет более точно установить нарушения ритма секреции кортизола (R. Eddy и соавт., 1973). Уровень свободного кортизола в плазме является наилучшим индикатором секреции кортизола. Как известно, кортизол в плазме находится в свободном и в связанном состоянии с транскортином (глобулин, связывающий кортикостероиды). При повышении образования кортизола содержание свободного кортизола увеличивается в большей степени по сравнению с общим кортизолом плазмы.
Описаны методы определения свободного кортизола в слюне. Уровень кортизола в слюне полностью отражает его содержание в плазме крови и этот показатель является интегрированным (усредненным) его содержанием за более длительный период (J.E. Shipley и соавт., 1992). Несмотря на определенные преимущества (полное исключение стресса), метод определения кортизола в слюне не нашел широкого распространения.
Гипогликемия, вызванная введением инсулина, является стрессовой ситуацией, приводящей к повышению АКТГ и СТГ в сыворотке крови у практически здоровых людей, тогда как при болезни Иценко-Кушинга секреция СТГ остается угнетенной, а уровень АКТГ – неизменно повышенным. При проведении этого теста следует иметь в виду, что в связи с тканевой (периферической) резистентностью к инсулину для получения у больного гипогликемического состояния дозу вводимого инсулина необходимо повышать до 0,15 ЕД/кг, а иногда и до 0,3 ЕД/кг.
Описан случай, когда у женщины, страдающей болезнью Иценко – Кушинга, повышение высвобождения АКТГ и высокий его уровень в плазме крови наблюдались в течение 12 ч, а в последующие 12 ч тех же суток содержание АКТГ в крови снижалось ниже уровня, наблюдаемого у практически здоровых лиц.
При опухолях надпочечников секреция АКТГ, как правило, угнетена и концентрация его в сыворотке крови ниже нормы.
Содержание кортизола и свободных 17-оксикортикостероидов (17-ОКС) в плазме крови, так же как и экскреция 17-ОКС с мочой, у лиц с болезнью Иценко-Кушинга, повышено. Экскреция 17-кетостероидов (17-КС) у части больных также повышена, т.к. АКТГ регулирует помимо глюкокортикоидов и секрецию надпочечниковых андрогенов, уровень последних повышен при болезни Иценко-Кушинга и АКТГ-эктопированном синдроме, при доброкачественных аденомах надпочечника, которые, как правило, секретируют почти исключительно глюкокортикоиды, которые ингибируют секрецию АКТГ и надпочечниковых андрогенов. Это обстоятельство используется при дифференциальной диагностике синдрома, особенно у женщин. Низкий уровень тестостерона, дегидроэпиандростерона сульфата и d-4-андро-стендиона в плазме крови характерен для доброкачественной опухоли надпочечника. Содержание надпочечниковых андрогенов может быть слегка повышено при болезни Иценко-Кушинга, что не может исключить наличие и синдрома эктопированного АКТГ. При раке надпочечника характерно высокое содержание андрогенов.
Следует отметить, что базальное определение 17-ОКС и 17-КС в моче длительное время использовалось для диагностики болезни Иценко-Кушинга. Однако их использование с этой целью ограничивается рядом обстоятельств. При таких состояниях как тиротоксикоз и ожирение экскреция этих соединений увеличивается, а при гипотирозе – уменьшается, что не соответствует истинному состоянию гипер- или гипокортицизма. Кроме того, некоторые вещества, такие, как барбитураты, фенилгидантоин, op-DDD (хлодитан) ускоряют обмен кортизола в печени и изменяют скорость образования и уровень кортизола в плазме. Поэтому показатели базального содержания 17-ОКС в моче больше не используют для диагностики синдрома Иценко-Кушинга.
В противоположность экскреции метаболитов кортизола с мочой (17-ОКС) экскреция свободного кортизола с мочой является идеальным маркером секреции кортикостероидов надпочечниками. Экскреция его с мочой коррелирует с уровнем свободного кортизола в плазме крови. Наряду с этим она правильно отражает скорость экскреции кортизола при различных (перечисленных выше) состояниях (более того, является наиболее чувствительным маркером суточной его секреции) и соответствует биологически активной форме кортизола.
Для уточнения диагноза болезни и синдрома Иценко-Кушинга проводятся диагностические пробы с дексаметазоном и метопироном.
Проба с дексаметазоном (проба Лиддла). Проводится в виде малого и большого тестов. Дексаметазон является центральным блокатором секреции АКТГ. При малом тесте дексаметазон дают больному по 0,5 мг каждые 6 ч в течение суток (т.е. в 8 ч утра, в 14 ч, 20 ч и 2 ч утра). Мочу для определения 17-ОКС или свободного кортизола собирают с 8 ч утра до 8 ч утра два дня до назначения дексаметазона и также два дня в те же временные промежутки после приема указанных доз дексаметазона. Эти дозы дексаметазона угнетают образование кортикостероидов почти у всех практически здоровых лиц. Через 6 ч после последней дозы дексаметазона содержание кортизола в плазме ниже 135-138 нмоль/л (меньше 4,5-5,0 мкг/100 мл). Снижение экскреции 17-ОКС ниже 3 мг/сут, а свободного кортизола ниже 54-55 нмоль/сут (ниже 19-20 мкг/сут) исключает гиперфункцию коры надпочечников. У лиц, страдающих болезнью или синдромом Иценко-Кушинга, при проведении малого теста изменения секреции кортикостероидов не отмечается.
При проведении большого теста дексаметазон назначают по 2 мг каждые 6 ч в течение 2 сут (т.е. 8 мг дексаметазона в день). Также проводят сбор мочи для определения 17-ОКС или свободного кортизола (при необходимости определяют свободный кортизол в плазме крови). При болезни Иценко-Кушинга отмечается снижение экскреции 17-ОКС или свободного кортизола на 50% и более, в то время как при опухолях надпочечников или АКТГ-эктопированном (или кортиколиберин-эктопированном) синдроме экскреция кортикостероидов не изменяется (схема 17). У некоторых больных с АКТГ-эктопированным синдромом снижения экскреции кортикостероидов не выявлялось даже после приема дексаметазона в дозе 32 мг в день.
Date: 2015-07-01; view: 1244; Нарушение авторских прав