
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Схема 13. Контроль секреции и высво- бождение соматолиберина
|
|
СЛН – соматолиберинпродуцирующий нейрон; 1 – серотонин; 2 – дофамин; 3 – альфа-адренергическое влияние норадреналина; 4 – бета-адренергическое влияние норадреналина. Сплошные стрелки – стимулирующее влияние, пунктирные – угнетающее влияние на секрецию соматолиберина.
Показано, что очищенные препараты соматолиберина, комплексируясь с рецепторами, расположенными на мембранах соматотрофов, стимулируют секрецию СТГ посредством активирования аденилатциклазы и повышения количества цАМФ. Наряду с этим активируется фосфатидилинозитоловая система с последующим повышением фосфорилирования различных ферментов гормоно-рецепторного комплекса. Это стимулирующее влияние соматолиберина блокируется соматостатином и усиливается глюкокортикоидами (W. Wehrenberg и соавт., 1983).
Соматолиберин широко применяется в клинической практике. Так, проба с внутривенным введением соматолиберина применяется для изучения секреции гормона роста. Чаще используют однократное введение соматолиберина в дозе 50, 100 или 200 мкг (из расчета 1 или 3,3 мкг на 1 кг массы тела). Содержание СТГ в сыворотке крови повышается с 0,7-2,0 до 20-30 нг/мл, а максимальных показателей достигает через 15-30 мин. Соматолиберин применяется и для лечения больных нанизмом, обусловленным первичным поражением гипоталамуса и нарушением вследствие этого секреции СТГ.
Соматостатин. При попытках выделить из гипоталамуса овец соматолиберин в лаборатории, руководимой Р. Гелемином, в 1973 г. был получен полипептид, который угнетал высвобождение гормона роста из культуры гипофиза крыс (P. Brazeau и соавт., 1973). В том же году была расшифрована структура соматостатина с такой последовательностью аминокислотных остатков: Ala-Gly-Cys-Lys-Asn-Phe-Phe-Trp-Lys-Thr-Phe-Thr-Ser-Cys. Таким образом, соматостатин является тетрадекапептидом, в 3-м и 14-м положениях содержит два цистеиновых остатка и существует в окисленной и восстановленной формах, причем каждая из них обладает одинаковой биологической активностью. Циклическая форма, по некоторым данным, оказывает более сильное ингибирующее действие на секрецию СТГ и инсулина.
L. Pradayrol и соавт. (1980) первыми показали, что в тканях соматостатин присутствует в нескольких формах и, в частности, в форме белка, химическая структура которого включает 28 аминокислотных остатков со следующей последовательностью: Ser-Ala-Asn-Ser-Asn-Pro-Ala-Met-Ala-Pro-Arg-Glu-Arg-Lys-Ala-Gly-Cys-Lys-Asn-Phe-Phe-Trp-Lys-Thr-Phe-Thr-Ser-Cys. Молекулярная масса соматостатина-14 равна 1638, 12 D, а соматостатина-28 -3149 D (дальтон). Ген, ответственный за синтез соматостатина, локализуется на 3-й хромосоме.
Обе формы соматостатина являются биологически активными. Цитоиммунохимическими исследованиями показано, что соматостатин-14 выявляется в основном в ЦНС, тогда как соматостатин-28 – в желудочно-кишечном тракте, преимущественно в толстом кишечнике. При использовании иммунолюминесцентного метода было обнаружено, что соматостатин локализуется в нервных окончаниях наружного слоя срединного возвышения и в вентромедиальном ядре, которое считается основным гипоталамическим образованием, осуществляющим регуляцию секреции СТГ. Кроме того, соматостатин выявляется и в области дугообразного ядра, где он присутствует как в клетках и нервных окончаниях, так и в аксонах, проходящих через это ядро. Основные сплетения соматостатинсодержащих нервных волокон располагаются в вентромедиальном и дугообразном ядрах и далее распространяются каудально в вентральные сосцевидные ядра. Установлено также, что нейроны, секретирующие соматостатин, выявляются в паравентрикулярных ядрах. Аксоны этих клеток распространяются латерально и вентрально по направлению к перекресту зрительных нервов, а далее идут каудально к области срединного возвышения. Приведенные выше дугообразное и вентромедиальное ядра получают соматостатинсодержащие нервные волокна из других источников. В частности, нервные окончания, содержащие соматостатин, обнаружены в вентромедиально-дугообразном комплексе, супрахиазматических ядрах и в вентральных премамиллярных ядрах. Эти данные свидетельствуют о том, что соматостатин выполняет функцию не только гормона, но и нейропередатчика или нейромодулятора. Такая возможность подтверждается тем, что соматостатинсодержащие клетки обнаружены в спинальных ганглиях, а нервные волокна, содержащие соматостатин, выявляются в дорсальных рогах спинного мозга, периферических симпатических нейронах, превертебральных ганглиях, нижнем и верхнем мезентериальных узлах. В этой связи интерес представляют работы последних лет, в которых показано, что соматостатин вовлечен в такие важные функции мозга, как сознание, память, двигательная активность, вегетативная и эндокринная регуляция. M-F. Chesselet и соавт. (1995) показали, что соматостатин и его мРНК экспрессируются в полосатом теле мозга, которое вовлечено в двигательную активность и поведенческие реакции организма. Ишемия этих участков мозга увеличивает экспрессию гена соматостатина. И, наоборот, уровень соматостатиновой мРНК снижается после применения галоперидола, антипсихотических препаратов, которые способствуют развитию экстрапирамидных симптомов. Авторы справедливо считают, что выявляемая повышенная экспрессия гена соматостатина при патологических состояниях имеет прямое отношение к появлению при этом различных клиничесих симптомов. Кроме того, перерыв дофаминергической иннервации также приводит к повышению экспрессии гена соматостатина в этой области, что является дополнительным подтверждением участия соматостатина в нарушении двигательных реакций, столь характерных для болезни Паркинсона.
Соматостатин оказывает свое биологическое влияние через комплексирование с рецепторами, расположенными на мембранах клеток. В настоящее время различают 5 типов рецепторов к соматостатину, которые неодинаково экспрессируются как в тканях различных областей ЦНС, так и в периферических тканях. Все типы рецепторов экспрессируются в передней доле гипофиза и в гипоталамусе, что указывает на участие этих областей в модуляции секреции гормона роста. M. Berelovitz и соавт. (1995) показали, что сахарный диабет и депривация пищи приводят к уменьшению мРНК рецепторов к соматостатину 1, 2 и 3-го типа в гипофизе примерно на 80% по сравнению с контрольными животными, получающими нормальное питание. При этом количество мРНК рецепторов 4 и 5 типа остается без изменений. Также не изменяется количество мРНК всех видов рецепторов в гипоталамусе. В гипофизе диабетических крыс сниженное количество мРНК рецепторов 1, 2 и 3 типа на 50-80% по сравнению с контрольными животными восстанавливается при проведении инсулинотерапии, но только в отношении мРНК рецепторов 1 типа. Экспрессия мРНК рецепторов 4 типа в гипофизе и всех четырех типов в гипоталамусе при этом остается без изменений. Экспрессия же рецепторов 5 типа в гипофизе, сниженная при диабете на 70% и на 30%, в гмпоталамусе восстанавливается при введении инсулина. Эти исследования четко показывают взаимосвязь количества рецепторов к соматостатину с состоянием обмена веществ. Исходя из структуры и фармакологических свойств рецепторы к соматостатину разделяют на две группы (два семейства): к первой группе относятся рецепторы 2, 3 и 5-го типа, которые раньше по фармакологическим характеристикам относили к соматостатиновым рецепторам 1-го типа; ко второй группе относятся рецепторы 1-го и 4-го типа, ранее называемые соматостатиновыми рецепторами 2-го типа. Таким образом, исследования показали, что соматостатиновые рецепторы относятся к группе с 7 трансмембранными фрагментами и кодируются генами, расположенными на различных хромосомах. Ген рецептора 1-го типа локализуется на 14-й; 2-го типа-на 17-й; 3-го типа-на 22-й; 4-го типа-на 20-й и 5-го типа – на 16-й хромосоме. Рецепторы 1-4-го типа практически эквивалентно комплексируются с соматостатином -14 и 28, тогда как рецепторы 5-го типа почти селективно комплексируются с соматостатином, имеющим структуру, включающую 28 аминокислот. Установлена различная аффинность рецепторов к соматостатину и его аналогам. Так, аналог соматостатина октреотид (SMS 201-995) взаимодействует с рецепторами 2 и 3 типа, очень незначительно с рецепторами 5-го типа. Другой аналог соматостатина – соматулин (BIM 23014) комплексируется с рецепторами 2-го и 5-го типа и лишь незначительно с рецепторами 3-го типа.
Изучая экспрессию соматостатиновых рецепторов 1 и 2 типа в гипоталамусе, A. Beaudet и G. Tannenbaum (1995) установили различную их концентрацию в ядрах гипоталамуса (преоптическая область, супрахиазматическое ядро, дугообразное ядро, паравентрикулярное и перивентрикулярное ядро, вентральные премамиллярные ядра), что указывает на участие этих рецепторов в центральной регуляции секреции соматолиберина и соматостатина.
Механизмы передачи гормонального сигнала в соматостатиновых рецепторах интенсивно изучаются в последние годы. A. Schonbrunn и соавт. (1995) показали, что соматостатиновые рецепторы в экзокринной части поджелудочной железы осуществляют трансдукцию гормонального сигнала через активирование двух подтипов G-белка: Gia1 и Gia3. Соматостатиновые рецепторы экзокринной части поджелудочной железы относятся к соматостатиновым рецепторам 2-го типа, тогда как в гипофизарных клетках выявляются соматостатиновые рецепторы 1-го и 2-го типа. Взаимодействие соматостатина с клетками гипофиза ведет к увеличению количества соматостатиновых рецепторов независимо от количества вновь синтезированного белка.
Работы по идентификации соматостатиновых рецепторов в различных тканях организма неожиданно привели к разработке методов ранней диагностики опухолей, секретирующих различные гормоны. Так, S. Lamberts и соавт. (1995) показали, что рецепторы к соматостатину присутствуют в большинстве опухолей, секретирующих гормоны. Для визуализации рецепторов к соматостатину применяют октреотид, меченный радиоактивным индием. С помощью этого препарата визуализируются в 70-100% опухоли, секретирующие гормон роста, ТТГ, опухоли островков поджелудочной железы, карциноидные опухоли, параганглиомы, феохромоцитомы, медулярный рак щитовидной железы, мелкоклеточный рак легких. Кроме того, менингиомы, рак почек, рак молочной железы, злокачественные лимфомы часто имеют также рецепторы к соматостатину, что позволяет проводить их диагностику с помощью различных сканирующих процедур. Причем исследования, проведенные с использованием соматостатина-14, соматостатина-28 и октреотида, показали различия в количестве связывающих мест к перечисленным гормонам, что указывает на определенные различия в соматостатиновых рецепторах. Помимо этого, для выявления первичной опухоли или ее метастазов во время операции применяется октреотид (аналог соматостатина), меченный радиоактивным йодом.
Соматостатин оказывает прямое действие на ЦНС. Он вызывает различные поведенческие, двигательные и электрофизиологические изменения при введении его в гиппокамп, кору головного мозга.
Показано, что соматостатин выявляется в d-клетках желудочно-кишечного тракта и поджелудочной железы. В желудке эти клетки располагаются в собственном слое слизистой оболочки антрального отдела, преимущественно в непосредственной близости от клеток, продуцирующих гастрин, что подтверждает влияние соматостатина на секрецию этого гормона. В кишечнике a-клетки выявляются в основном в собственном слое слизистой оболочки; незначительное их количество обнаруживается в криптах. В поджелудочной железе соматостатинсодержащие клетки локализуются по периферии панкреатических островков, располагаясь между a- и b-клетками.
Своеобразие распределения d-клеток, а именно их разбросанность среди других эндокринных клеток желудочно-кишечного тракта и поджелудочной железы представляет морфологическую основу для высвобождения и местного действия гормона на соседние клетки-мишени. В этом отношении соматостатин может рассматриваться как аналог других местных гормонов, к которым относятся, в частности, гистамин и серотонин.Кроме того, соматостатин, выявляющийся не только в клетках, где он секретируется, но и в нервных волокнах, в том числе желудочно-кишечного тракта, осуществляет свое действие и через нейрокринные механизмы, т.е. путем высвобождения из нервных окончаний.
Соматостатин оказывает влияние на моторную и секреторную функции пищеварительной системы, ее кровообращение и кишечную абсорбцию. Он задерживает эвакуацию желудочного содержимого, угнетая высвобождение мотилина – гормона, стимулирующего моторику желудочно-кишечного тракта, снижает сократитильную активность желчного пузыря путем торможения действия холецистокинина. У накормленных животных соматостатин тормозит высвобождение гастрина и холецистокинина, наблюдаемое после приема пищи.
Соматостатин угнетает секрецию поджелудочной железой инсулина и глюкагона. Это действие распространяется на обе фазы высвобождения инсулина, вызванного глюкозой, толбутамидом, глюкагоном или секретином. Из-за короткого периода полураспада соматостатина (около 4 мин) его тормозящее влияние заканчивается вскоре после прекращения инфузии. Угнетая секрецию глюкагона, соматостатин понижает концентрацию глюкозы в периферической крови путем уменьшения выхода ее из печени в воротную вену. Однако после внутривенной нагрузки глюкозой или длительного введения соматостатина вместо ожидаемого снижения уровня глюкозы в крови наблюдается гипергликемия, что объясняется одновременным значительным угнетением секреции инсулина.
В настоящее время доказаны следующие влияния соматостатина: 1) ингибирование секреции гастрина, секретина, ТТГ, СТГ, инсулина, глюкагона, мотилина, глицентина, ВИП, ренина; 2) угнетение секреции соляной кислоты и пепсина желудком, уменьшение моторики желудка, ингибирование секреции бикарбонатов и ферментов поджелудочной железой, снижение абсорбции в кишечнике, уменьшение кровотока на всем протяжении желудочно-кишечного тракта, снижение секреции и транспорта желчи.
В связи с тормозящим влиянием соматостатина на секрецию СТГ, глюкагона и инсулина высказывались предположения о возможности его использования в лечении сахарного диабета. Оказалось, однако, что соматостатин, угнетая секрецию инсулина, приводит к развитию еще более выраженной инсулиновой недостаточности. Большие надежды возлагались на получение аналогов соматостатина, обладающих исключительным влиянием на ингибирование секреции СТГ и глюкагона и интактным в отношении влияния на секреции инсулина. Полученный аналог соматостатина октреотид обладает рядом преимуществ по сравнению с соматостатином: имеет длительный период полураспада, что позволяет применять его 2-3 раза в сутки; ингибирует патологическую секрецию многих гормонов и может применяться при различных патологических состояниях, включая випому, карциноидный синдром, низидиобластоз, гастриному, соматотропиному (акромегалия). Кроме того, опубликованы данные о применении октреотида при тиротропиноме, желудочном кровотечении, перфорирующей язве желудка, глюкагономе, диарее как у детей, так и у взрослых.
Гормон роста усиливает синтез и увеличивает содержание соматостатина в гипоталамусе. Сниженное количество соматостатина в гипоталамусе гипофизэктомированных крыс восстанавливалось до нормы под влиянием экзогенного СТГ. Это указывает на существование положительного механизма обратной связи между СТГ и соматостатином и регуляции секреции СТГ по принципу “короткой”обратной связи.
Тиролиберин. Установлено, что высвобождение ТТГ из передней доли гипофиза регулируется гипоталамусом посредством тиротропин-рилизинг-гормона, или тиролиберина. Кстати, именно тиролиберин был первым из гипофизотропных гормонов с установленной химической структурой (C. Bowers и соавт., 1970), которая включает следующую последовательность аминокислот-: pGlu-His-Gly-NH2; мол. м. 362, 42Д. Вскоре после установления структуры тиролиберина он был синтезирован, причем биологическая активность натурального и синтетического препарата оказалась идентичной.
Синтез тиролиберина осуществляется посредством посттрансляционного отщепления последнего от большой молекулы предшественника. M. Yamada и соавт. (1990) клонировали и определили структуру человеческой геномной ДНК и гипоталамической кДНК, кодирующей человеческий препротиролиберин.В то же время P. Wu и соавт. (1988), изучая посттрансляционный процессинг предшественника тиролиберина, идентифицировали 3 новых пептида, производных протиролиберина. Установлено, что ген, ответственный за синтез препротиролиберина, локализуется на 3-й хромосоме (M. Yamada и соавт., 1991). Установлено, что экспрессия гена тиролиберина наблюдается как в нормальной, так и в аденоматозной ткани гипофиза. Молекула препротиролиберина человека включает 242 аминокислотных остатка, а аналогичная молекула крысиного препротиролиберина – 255 аминокислотных остатков. Показано, что в синтезе тиролиберина принимает участие тиролиберинсинтетаза, требующая присутствия АТФ и ионов магния. Она была обнаружена в различных областях мозга. Тироксин непосредственно влияет на активность тиролиберинсинтетазы, и синтез тиролиберина осуществляется по принципу отрицательной обратной связи. Цитоиммунохимические исследования показали, что тиролиберин широко представлен в ЦНС и желудочно-кишечном тракте. Нейроны, секретирующие тиролиберин, выявляются в медиальной и парвоцеллюлярной областях паравентрикулярного ядра. Второй по интенсивности содержания тиролиберина является область супрахиазматического преоптического ядра, дорзомедиального ядра и базолатерального гипоталамуса. Аксоны, содержащие тиролиберин, выявляются в дорзомедиальном ядре, медиальной области паравентрикулярного ядра, но наибольшая их концентрация отмечается в области срединного возвышения. Количество тиролиберина, локализованного в гипоталамусе, составляет всего 30-32% от его содержания в мозге. Остальная часть тиролиберина (около 70%) приходится на внегипоталамические области мозга (передний мозг, задняя часть промежуточного мозга, задний мозг, двигательные нейроны спинного мозга, ядра черепных нервов, нейрогипофиз, эпифиз).
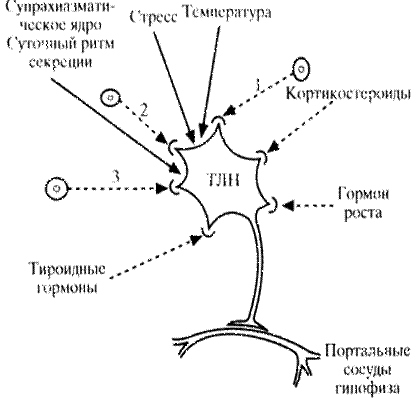
Тиролиберин, выявляемый в различных частях ЦНС, не является продуктом секреции клеток гипоталамуса. Помимо своей гипофизарной функции, тиролиберин в других областях ЦНС выполняет роль нейропередатчика или нейромодулятора и оказывает в основном стимулирующее влияние. Это проявляется повышением спонтанной двигательной активности, артериального давления, увеличением времени судорожного периода и летальности от стрихнина, увеличением двигательной активности у животных после введения им морфия. Тиролиберин потенцирует возбуждающее действие ацетилхолина на нейроны коры головного мозга, вызывает анорексию, повышает высвобождение норадреналина и дофамина из синаптосом и ускоряет период обмена норадреналина. Кроме того, он участвует в терморегуляции и вызывает гипертермию при введении его в желудочки мозга. Показано, что тиролиберин широко представлен в поджелудочной железе и желудочно-кишечном тракте. В антральном отделе желудка плода человека он выявляется в клетках, содержащих гастрин. Однако у взрослого человека эта колокализация двух гормонов не подтверждается (S. Grasso и соавт., 1992) В противоположность этому тиролиберин выявляется в поджелудочной железе как взрослого, так и плода. При этом в эмбриональном периоде содержание тиролиберина в поджелудочной железе значительно выше. Причем в поджелудочной железе, так же как и в желудке, тиролиберин колокализуется в одной клетке, а именно в b-клетке, содержащей инсулин. У человека назначение тиролиберина снижает скорость абсорбции глюкозы и ксилозы из кишечника (L.O. Dolva и соавт., 1978). Тиролиберин выявляется также в мочеполовых органах (простата, семенные пузырьки и др.). Его наличие выявлено в сетчатой оболочке, плаценте, экстрактах различных опухолей человека. Однако убедительных данных о биологической значимости тиролиберина в этих органах пока нет. Видимо, он оказывает паракринное или нейротрансмиттерное влияние. Механизмы контроля секреции и высвобождения тиролиберина представлены на схеме 14.
Date: 2015-07-01; view: 850; Нарушение авторских прав