
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гіппократ 2 page
|
|
Канальцева протеїнурія спричинюється порушенням реабсорбції біл-ків у канальцях і характеризується зростаючим виділенням із сечею білків з малою молекулярною масою, які вільно проходять через стінку клубочків (β2-макроглобулін, лізоцим, α1-мікроглобулін та ряд інших білків). При нефротичному синдромі протеїнурія становить 1–5 %. Більш висока протеїнурія, порівняно з гломерулонефритом, пояснюється двома причинами: а) більшою кількістю крові, що фільтрується у клубочках при нефрозі, ніж при гломерулонефриті; б) при ураженні канальців підвищується реабсорбція води, внаслідок чого концентрація білка в сечі зростає. Канальцева протеїнурія часто поєднується із клу-бочковою.
При нефросклерозі протеїнурія є незначною (0,1–0,2 %). Це пояснюється прогресуючим зменшенням кількості функціонуючих клубочків і зниженням внаслідок цього фільтрації білка.
Післяниркова протеїнурія розвивається при захворюваннях сечового міхура, уретри та уролітіазі. Кількість білка в сечі при цьому не перевищує 1 г/л.
Ниркова протеїнурія від післяниркової відрізняється більшим умістом білка в сечі (при післянирковій він рідко перевищує 1 г/л), наявністю в осаді сечі циліндрів та іншими симптомами ураження нирок. Трапляються випадки одночасного ураження нирок і сечовивідних шляхів. Така протеїнурія називається змішаною.
Протеїнурія також діагностується при захворюванні статевих органів: у самок – при запаленнях матки і піхви, у самців – при запаленні передміхурової залози. Якщо білок до сечі домішується зі статевих органів, то протеїнурія є несправжньою.
2.2. Визначення вмісту
глюкози в сечі
У сечі здорових тварин містяться сліди глюкози, які не виявляються хімічними реакціями, що застосовуються в лабораторіях, а тому сечу прийнято вважати вільною від глюкози та інших цукрів. Уміст глюкози слід визначати відразу після одержання сечі, оскільки за зберігання проб при кімнатній температурі під дією ферментів мікроорганізмів і грибків відбувається ферментативне зброджування вуглеводів. Серед усіх цукрів сечі найбільш важливе значення має вміст глюкози, оскільки інші вуглеводи в ній містяться в незначній кількості.
Уміст глюкози досліджують якісними і кількісними пробами. Для експрес-аналізу використовують індикаторні смужки. Якісні проби грун-туються на відновлювальних властивостях глюкози. Це проби Бенедикта, Гайнеса, Ніляндера, Фелінга та ін. Кількісне визначення цукрів у сечі проводять методом зброджування в цукрометрах Ейнгорна, Ласара-Кона, Альтгаузена, орто-толуїдиновим та глюкозо-оксидазним методами.
Якісні реакції
визначення глюкози в сечі
2.2.1. Проба Гайнеса
Принцип методу. Глюкоза у лужному середовищі окиснюється гідратом окису міді [ Cu(OH)2 ], що утворюється з міді сульфату. При нагріванні міді гідроксид (блакитного кольору) відновлюється, утворюючи гідрат закису міді жовтого кольору [ Cu(OH) ], який може розпадатися з утворенням закису міді (Cu2O) червоного кольору. Чутливість проби – близько 0,03 %.
Приготування реактиву Гайнеса. 0,5 г міді сульфату (CuSO4) розчиняють у 250 мл суміші, приготовленої з рівних об’ємів дистильованої води і чистого гліцерину. До отриманої рідини додають 100 мл розчину натрію гідроокису (12,5 г NaOH + 100 мл дистильованої води). Реактив зберігають у посуді з темного скла.
Хід визначення. В пробірку наливають 1–2 мл реактиву Гайнеса і підігрівають до кипіння. На гарячий реактив піпеткою нашаровують 1–2 мл попередньо підлуженої і профільтрованої сечі. За наявності глюкози на межі двох рідин утворюється золотисте кільце, а весь реактив поступово мутніє.
Проба дуже чутлива і може бути використана для дослідження сечі домашніх тварин усіх видів.
2.2.2. Проба Ніляндера
(проба на відновлення вісмуту)
Принцип методу. За наявності глюкози в сечі, вісмуту нітрат (тривалентний вісмут) при нагріванні спочатку відновлюється у вісмуту оксид коричневого кольору, а у подальшому – до металічного вісмуту (чорне забарвлення рідини).
Приготування реактиву Ніляндера. 2,0 г вісмуту нітрату змішують у ступці з 4,0 г сегнетової солі і отриману суміш розчиняють у 100 мл
10 %-ного розчину натрію гідроокису (NaOH). Розчин фільтрують. Реактив нестійкий при зберіганні.
Хід визначення. В пробірку наливають 3–5 мл профільтрованої сечі, додають 1–2 мл реактиву Ніляндера, обережно нагрівають суміш і ки-п’ятять протягом 3 хв, тримаючи над полум’ям верхню частину пробірки. За наявності глюкози в сечі на початку кип’ятіння рідина поступово набуває темно-коричневого, а потім – чорного забарвлення. Чутливість проби становить 0,05%.
Примітка. За наявності білка і альбумоз у сечі кип’ятінням з вісмуту нітратом (ІІІ) у лужному середовищі від’єднується сірка і утворюється вісмуту сульфат (ІІІ) з розвитком чорного забарвлення, так як і в реакції за наявності глюкози у сечі. Чорне забарвлення рідини в пробірці з відновленням вісмуту утворюється також за наявності в сечі деяких препаратів (саліцилова кислота, антипірин та ін.).
2.2.3. Проба з сегнетовою сіллю
Для аналізу беруть два реактиви – 5 %-ний розчин міді сульфату (CuSO4) і 20 %-ний розчин сегнетової солі в 4 %-ному розчині КОН (100 мл).
Хід визначення. В пробірку наливають 1,5 мл розчину міді сульфату і 3 мл розчину сегнетової солі. Суміш реактивів обережно підігрівають до кипіння і на гарячий реактив нашаровують 4,5 мл підігрітої сечі. За наявності глюкози у сечі рідина набуває жовтого забарвлення і настає її помутніння.
кількісне визначення цукрів у сечі
Кількісне визначення цукрів у сечі проводять шляхом зброджування у цукрометрах Ейнгорна, Ласара-Кона, Альтгаузена, а також поляризаційним, орто-толуїдиновим і глюкозо-оксидазним (ферментативним) методами.
2.2.4. Визначення глюкози
глюкозо-оксидазним методом
Принцип методу. Глюкоза в присутності глюкозооксидази окиснюється до глюконової кислоти і перекису водню, який у присутності пероксидази взаємодіє з фенолом і 4-амінофеназоном з утворенням хіноніміну червоно-фіолетового кольору, інтенсивність забарвлення якого є прямо пропорційною концентрації глюкози в сечі.
Обладнання: фотоелектроколориметр, фотометр, спектрофотометр (дов-жина хвилі 500–546 нм), кювети з товщиною робочого шару 5 або 10 мм.
Реактиви: 1) розчини ферментів – пероксидаза 7500 U/л; 2) буферний розчин – фосфатний буфер (рН 7,4); 3) антикоагулянт – суха суміш 0,536 г натрію щавелевокислого і 3,4 г натрію хлориду; 4) стандартний розчин глюкози – 10,0 ммоль/л (1802 мг/л).
Приготування робочого розчину. У колбу ємністю 200 мл перенести вміст флакона з буферним розчином, додати 100–120 мл дистильованої води, розчин ферментів і довести до мітки дистильованою водою.
Хід визначення. В дослідну пробірку піпеткою відбирають 0,02 мл сечі і додають 2,0 мл робочого розчину. Перемішують, витримують 20 хв при кімнатній температурі (+ 18–25 °С), або 12 хв при температурі 37 °С.
Контрольний розчин – 0,02 мл 0,85 %-ного розчину натрію хлориду і 2,0 мл робочого розчину (інкубація проводиться аналогічно дослідному зразку).
Визначають екстинцію дослідної проби проти контролю при довжині хвилі 500–546 нм.
Результат визначають за формулою:
Х (ммоль/л) = 10 × Дп (дослідна проба) × коеф. розведення.
Примітка. Сечу перед дослідженням розвести у 10–50 разів.
2.2.5. Визначення глюкози
за кольоровою реакцією з ортотолуїдином
Принцип методу. Глюкоза при нагріванні з ортотолуїдином (реактив токсичний!) у розчині оцтової кислоти утворює сполуку, інтенсив-ність кольору якої пропорційна концентрації глюкози.
Обладнання: ФЕК-56 М, КФК-2 або КФК-3, водяна баня.
Реактиви: 1) 3 %-ний розчин трихлороцтової кислоти (ТХОК);
2) ортотолуїдиновий реактив: у 94 мл льодяної оцтової кислоти розчиняють 0,15 г тіосечовини і додають 6 мл ортотолуїдину. Реактив стійкий при зберіганні в холодильнику; 3) 500 мг%-ний стандартний розчин глюкози, приготовлений у 0,2 %-ному розчині бензойної кислоти.
Хід визначення. У пробірку вносять 1,8 мл 3 %-ного розчину ТХОК і додають до неї 0,2 мл свіжої або стабілізованої сечі. Центрифугують 15 хв при 1500 об/хв. У чисту пробірку відбирають 0,5 мл центрифугату і
додають 4,5 мл ортотолуїдинового реактиву. Пробірки ставлять у киплячу водяну баню (вода має безперервно кипіти) точно на 8 хв, потім виймають їх, одразу охолоджують під проточною водою. Оптичну щільність вимірюють на фотоелектроколориметрі (ФЕК-56М, КФК-2, КФК-3) при довжині хвилі 590–650 нм (оранжевий або червоний світлофільтр) у кюветі з товщиною шару 1 см. Контроль: 0,5 мл ТХОК +
+ 4,5 мл ортотолуїдинового реактиву.
Стандартна проба ставиться як і дослідна, але замість сечі беруть стандартний розчин глюкози з концентрацією 50–100 мг/100 мл.
Розрахунок проводять за формулою:
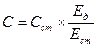 ,
,
де С – концентрація глюкози у пробі, мг/100 мл крові; Сст – концентрація глюкози у стандарті; Ед – оптична щільність дослідної проби; Ест – оптична щільність стандарту.
Примітка. Сечу перед дослідженням розвести у 10–50 разів.
2.2.6. Експрес-метод визначення кількості
глюкози в сечі
Проводиться за допомогою діагностичних смужок ГлюкоФАН, Пента ФАН, НонаФАН (La-Chema, Чехія). Діагностичну смужку необхідно опустити у свіжу сечу і не пізніше 1 хв порівняти її забарвлення з відповідною кольоровою шкалою на тубусі. Результат виражається в ммоль глюкози на 1 л сечі.
Діагностичне значення глюкозурії
Виділення глюкози із сечею називають глюкозурією. Рівень глюкози в крові, за якого починається глюкозурія, називається нирковим порогом. У моногастричних тварин він становить 8–9 ммоль/л, у жуйних – 5–6, людини – 10 ммоль/л. При ураженні нирок канальці втрачають здат-ність до реабсорбції глюкози, тому величина порогу знижується, і глюкоза починає виділятися із сечею при нормальній її концентрації в крові.
Глюкозурія буває фізіологічною і патологічною. Фізіологічна глюкозурія спостерігається при поїданні тваринами великої кількості кормів, що містять цукор, після значного фізичного навантаження, у перед- і післяродовий періоди, при внутрішньовенному введенні глюкози і гіпертонічного розчину натрію хлориду. Короткочасна фізіологічна глюкозурія є наслідком збудження симпатичного відділу автономної нервової системи, що, очевидно, супроводжується посиленим розпадом глікогену в печінці.
Патологічна глюкозурія виникає при ураженні центральної нервової системи (неінсулярна), інсулярного апарату підшлункової залози та інших залоз внутрішньої секреції (ендокринна), а також при ураженні нирок (ренальна).
Неінсулярна глюкозурія розвивається при ураженні центральної нервової системи (сказ, чума собак, лістеріоз, менінгоенцефаліт, травми і пухлини мозку) та деяких отруєннях. Серед ендокринних глюкозурій виділяють глюкозурії, спричинені недостатньою секрецією інсуліну (діабетична), гіперфункцією надниркових залоз (мозкової речовини і рідше – кори), гіпофіза та щитоподібної залози. До цієї ж групи належить печінкова глюкозурія, яка спричинюється порушенням глікогеносинтезувальної функції печінки.
Ренальна глюкозурія зумовлюється зниженням реабсорбції глюкози в ниркових канальцях (“ ренальний діабет ”) і може спостерігатися при хворобах нирок (гломерулонефриті, нефротичному синдромі, нефросклерозі). У таких випадках рівень глюкози в крові нормальний або навіть дещо знижений. Зниження реабсорбції глюкози в канальцях виникає внаслідок зменшення активності ферментів, які забезпечують цей процес (гексокінази і глюкозо-6-фосфатази).
При маститах і закупорюванні дійок у тварин може розвиватися лак-тозурія – внаслідок зворотного надходження молочного цукру з молока в кров і сечу. Лактозурію від глюкозурії відрізняють постановкою зброд-жувальної проби. Галактоза в сечі (галактозурія) з’являється при ураженнях печінки, м'язовій дистрофії та панкреатиті. Поява інших цукрів у сечі спостерігається досить рідко.
2.3. Визначення кетонових тіл
у сечі
До кетонових тіл належать ацетон, бета-оксимасляна та ацетооцтова кислоти. У здорових тварин сеча містить незначну кількість кетонових тіл, які не визначаються якісними реакціями (проба Лестраде дозволяє виявити кетонові тіла в сечі від 1,7 ммоль/л і вище). Використання індикаторних смужок, виготовлених спеціально для кожного виду тварин, допомагає виявляти посилене виділення кетонових тіл, концентрація яких є трохи вищою за верхню межу норми. Нині випускають смужки, за допомогою яких визначають приблизну концентрацію кетонових тіл у сечі, а точну їх кількість досліджують у спеціальних дистиляційних апаратах.
2.3.1. Проба Лестраде
Принцип методу. Натрію нітропрусид при взаємодії з ацетоном сечі у лужному середовищі утворює комплексну сполуку, що забарвлюється у вишнево-червоний колір.
Приготування реактиву. 1,0 г натрію нітропрусиду (Na2[Fe(CN)5NO]) змішують з 20,0 г амонію сульфату [(NH4)2SO4] і 20,0 г натрію карбонату (Na2CO3) безводного. Реактив зберігають у флаконі зі скла темного кольору.
Хід визначення. На предметне скло насипають 0,1–0,2 г реактиву Лестраде (набирають на кінець скальпеля) і додають 2–3 краплі сечі. При позитивній реакції утворюється рожеве або червоно-фіолетове забарвлення.
2.3.2. Проба Ротера
Принцип методу такий же, як і проби Лестраде.
Реактиви: 1) сульфат амонію (NH4)2SO4 в порошку; 2) аміак концент-рований; 3) 5 %-ний свіжоприготовлений розчин натрію нітропрусиду (Na2[Fe(CN)5NO].
Хід визначення. В пробірку наливають 5–8 мл сечі і насичують її амонію сульфатом. Добавляють 2 або 3 краплі концентрованого аміаку і 5 крапель розчину натрію нітропрусиду, перемішують. Утворюється темно-червоне або фіолетове забарвлення.
2.3.3. Проба Росса
Приготування реактиву Росса. 1,0 г натрію нітропрусиду змішують з 99 г амонію сульфату.
Хід визначення. У пробірку насипають 1,0 г реактиву Росса, наливають піпеткою 5 мл сечі, додають 1 кристалик NaOH і перемішують. Результати реакції читають через 5 хв при температурі не менше 18 °С. За наявності кетонових тіл у сечі вміст пробірки забарвлюється у червоно-фіолетовий колір.
2.3.4. Експрес-метод визначення
кількості кетонових тіл
Нині випускають діагностичні індикаторні смужки, за допомогою яких визначають приблизну концентрацію кетонових тіл у сечі: “Кето-тест” (Росія), Кето Фан і Діа ФАН (La-Chema, Чехія), Penta ФАН. Діа-гностичну смужку опускають в сечу і протягом 1 хв порівнюють колір із стандартом, який нанесений на тубус. В основі тесту лежить реакція Легала. Проба більш чутлива до ацето-оцтової кислоти, ніж до ацетону, і не чутлива до b-гідроксимасляної кислоти. Кольорова шкала на етикет-ці відображає концентрацію ацето-оцтової кислоти в сечі. Ця проба дозволяє виявити кетонові тіла у сечі від 1,5 до 15 ммоль/л.
Діагностичне значення кетонурії
У здорових коней уміст кетонових тіл у сечі становить 0,06–
0,66 ммоль/л, у корів – 0,6–1,5, овець – 0,59–1,46 ммоль/л. Збільшення вмісту кетонових тіл у сечі називається кетонурією. Зумовлена вона недостатнім забезпеченням жуйних тварин енергією, легкотравними вуглеводами в поєднанні з високим умістом у раціонах білків і жирів та при згодовуванні кормів, які містять кетогенні речовини (масляну кислоту). Кетонурія є також наслідком тривалого голодування або виснаження тварин, а також підвищення температури тіла. Діагностують кетонурію при цукровому діабеті, нирковій глюкозурії, кетозі, діареях, тяжких інтоксикаціях, захворюваннях печінки, центральної нервової системи (сказ, лістеріоз, еклампсія). Визначення кетонових тіл у сечі є високоінформативним і раннім тестом при діагностиці прихованої форми кетозу корів і овець.
2.4. Визначення білірубіну в сечі
У сечі здорових тварин білірубін звичайними методами лабораторного дослідження не визначається. При патології в сечі може міститися лише кон’югований (зв’язаний, прямий) білірубін. Некон’югований
(вільний, непрямий) білірубін не розчиняється у воді і не проходить через ниркові клубочки, тому в сечі його не виявляють. Уміст білірубіну в сечі визначають якісними і кількісними реакціями та індикаторними смужками. З якісних реакцій застосовують проби Розіна, Фуше, Франка, які грунтуються на окисненні білірубіну в білівердин, що надає пробі зеленуватого забарвлення. Для великої рогатої худоби інформативною є проба Франка (із розчином метиленового синього). Кількість білірубіну в сечі досліджують уніфікованим методом Ієндрашика, Клегорна і Грофа.
2.4.1. Проба Розіна
Принцип методу ґрунтується на властивості білірубіну окиснюватися в білівердин у присутності речовин-окиснювачів (йод, азотна і три-хлороцтова кислоти).
Реактив: 1) розчин Люголя (1 г йоду і 2 г калію йодиду розчиняють у 300 мл дистильованої води); або 2) 1 %-ний спиртовий розчин йоду.
Хід визначення. До 4–5 мл сечі нашаровують розчин Люголя чи 1 %-ний спиртовий розчин йоду. За наявності в сечі білірубіну на межі двох рідин утворюється зелене кільце.
2.4.2. Проба Фуше
Принцип методу ґрунтується на окисненні білірубіну заліза хлоридом у білівердин після осадження барію хлоридом.
Реактиви: 1) 15 %-ний розчин барію хлориду; 2) реактив Фуше (100 мл 25%-ного розчину трихлороцтової кислоти + 10 мл 10 %-ного розчину заліза півторахлорного).
Хід визначення. До 10–12 мл досліджуваної сечі додають 5–6 мл
15 %-ного розчину барію хлориду, перемішують (барію хлорид осаджує білірубін). Уміст пробірки фільтрують. На витягнутий з лійки фільтр (попередньо його розправляють на сухому фільтрувальному папері) наносять 2–3 краплі реактиву Фуше. За наявності в сечі білірубіну на
фільтрі з’являється зелено-синє чи блакитне забарвлення. Ця проба є однією з найбільш чутливих і застосовується у випадках, коли отримані неясні чи сумнівні результати з іншими реактивами.
2.4.3. Експрес-метод визначення
білірубіну в сечі
Використовують індикаторні смужки ГексаФАН, Гепта-, Окта-, Нона-ФАН СГ, Дека-ФАН АСКО, Дека-ФАН Лейко, Ікто-ФАН (La-Chema, Чехія). На визначення білірубіну не впливає рН сечі, проте її слід оберігати від дії прямого сонячного проміння, оскільки це призводить до заниження показників або отримання негативного результату.
Діагностичне значення білірубінурії
У здорових тварин білірубін у сечі якісними пробами не виявляється. Виділення білірубіну із сечею називають білірубінурією. Наявність його в сечі свідчить про глибокі порушення в гепатобіліарній системі, коли кількість кон’югованого білірубіну в крові перевищує рівень ниркового порогу. При білірубінурії сеча темніє, набуває жовто-зеленого відтінку, піниться.
Дослідження білірубіну в сечі має важливе значення при диференційній діагностиці жовтяниць. Білірубінурія спостерігається при тяжких ураженнях печінки (гепатит, гепатодистрофія, цироз) та жовчовивідних шляхів (жовчнокам’яна хвороба, ехінококоз, новоутворення), що супроводжуються розвитком паренхіматозної і механічної жовтяниці. Причиною білірубінурії при паренхіматозній жовтяниці є проникнення кон’югованого білірубіну в кров унаслідок руйнування і некрозу гепатоцитів. За непрохідності жовчних шляхів (механічна жовтяниця) у них виникає застій жовчі, у результаті чого пошкоджуються жовчні капіляри, через які кон’югований білірубін проникає в кров’яне русло, а з кров’ю заноситься в нирки і виділяється із сечею. При гемолітичній жов-тяниці білірубінурія відсутня, оскільки в крові нагромаджується лише некон’югований (вільний, непроведений через печінку) білірубін, який не розчиняється у воді і не може виділитися нирками із сечею. Таким чином, білірубінурія властива лише механічній і паренхіматозній жовтяницям (табл. 2).
Таблиця 2 – Диференціація жовтяниць за результатами дослідження сечі
| Показники | Жовтяниці | ||
| гемолітична | паренхіматозна | механічна | |
| Білірубінурія | – | + | + |
| Уробіліногенурія | + | + | – |
2.5. Визначення уробіліногену
та уробіліну і жовчних кислот у сечі
Для якісного визначення уробіліну існує цілий ряд проб: Флоренса-Комарицина, Богомолова, Шлізінгера. Виявляють уробілінурію також індикаторними смужками відразу після сечовиділення, коли уробіліноген окиснюється в уробілін. Мінімальна кількість уробіліногену в сечі, яку можна виявити індикаторними смужками, становить 17 мкмоль/л
(1 мг/100 мл), максимальна – 203 мкмоль/л.
2.5.1. Проба Флоренса-Комарицина
Принцип методу. Для визначення уробілінових тіл у сечі з неї поперед-ньо видаляють білірубін і гемоглобін (за наявності). Для цього до 8 мл досліджуваної сечі додають 2 мл 10 %-ного розчину кальцію хлориду (чи барію хлориду) і кілька крапель концентрованого розчину аміаку до лужної реакції. Отриману суміш фільтрують і у фільтраті визначають уробілін. З соляною кислотою уробілін утворює сполуку, зафарбовану в червоний колір.
Реактиви: 1) концентрована сірчана кислота; 2) етиловий спирт;
3) концентрована соляна кислота.
Хід визначення. До 8–10 мл сечі додають декілька крапель концентрованої сірчаної кислоти (для підкислення), збовтують і додають 1–2 мл етилового або сірчанокислого ефіру. Пробірку щільно закривають корком і обережно змішують рідини. В іншу пробірку вносять 2–3 мл концентрованої соляної кислоти. З першої пробірки піпеткою відбирають ефірну витяжку і нашаровують її на соляну кислоту в другій пробірці. На межі двох рідин у присутності уробіліну утвориться рожеве або червонувато-коричневе кільце, інтенсивність забарвлення якого пропорційна вмісту уробіліну в сечі.
2.5.2. Проба Богомолова
Принцип методу. Уробілін з міді сульфатом утворює сполуку червоно-рожевого кольору.
Реактив: 1) 10 %-ний розчин міді сульфату; 2) хлороформ; 3) соляна кислота.
Хід визначення. До 8–10 мл профільтрованої сечі додають 10 крапель 10 %-ного розчину міді сульфату. Якщо після внесення розчину CuSO4 з’являється помутніння внаслідок утворення міді гідроокису, додають кілька крапель соляної кислоти до просвітління розчину. Через 5 хв добавляють 1–1,5 мл хлороформу. Утворення в осаді після перемішування розчину рожево-червоного забарвлення свідчить про уробілінурію.
Діагностичне значення уробіліногенурії
Уробіліноген є похідним проведеного через печінку білірубіну й утворюється в позапечінкових жовчних шляхах і кишечнику з білірубіну під впливом ферментів мікроорганізмів. У кишечнику частина його всмоктується в кров і через ворітну вену надходить у печінку, де повніс-тю руйнується. Таким чином, у здорових тварин уробіліноген не виді-ляється із сечею.
Основна кількість білірубіну й уробіліногену в кишечнику перетворюється в стеркобіліноген, який майже повністю виділяється з калом. На повітрі стеркобіліноген окиснюється в стеркобілін. Лише незначна кількість його всмоктується в систему каудальної порожнистої вени і виводиться із сечею, але ця кількість настільки мала, що не виявляється якісними методами.
Уробіліноген і стеркобіліноген часто об’єднують в одну групу – уробіліногенових тіл, які на повітрі окиснюються і перетворюються в уробілінові тіла. Підвищення кількості уробіліногенових тіл у сечі, коли вони виявляються за допомогою якісних реакцій, називається уробіліногенурією.
Уробіліногенурія є показником паренхіматозної або гемолітичної жовтяниці (див. табл. 2). При ураженні печінки (паренхіматозна жовтяниця) уробіліноген не повністю руйнується гепатоцитами, заноситься кров’ю в нирки і виділяється із сечею. Відразу після виділення уробіліноген під дією кисню перетворюється в уробілін.
Збільшення кількості уробіліну в сечі називають уробілінурією. Уробіліногенурія спостерігається не лише при паренхіматозній жовтяниці, а й при гемолітичній, коли утворюється велика кількість уробіліногену, який, очевидно, не встигає розщеплюватися в печінці. Окрім того, при цій жовтяниці в кишечнику утворюється багато стеркобіліногену, який, обминаючи печінку, потрапляє в нирки і виводиться із сечею. Виділення стеркобіліногену із сечею спостерігається також при кишкових за-
хворюваннях (ентероколіти, завороти, інвагінація), коли він із товстих кишок всмоктується в кров і надходить у нирки.
Відсутність уробіліногену в сечі при збільшенні вмісту білірубіну в крові і сечі свідчить про наявність в організмі механічної жовтяниці. При усуненні механічної перешкоди в жовчному протоці виникає уробілінурія, яка є сприятливим показником.
2.5.3. Визначення вмісту
жовчних кислот у сечі
Наявність жовчних кислот у сечі визначають за допомогою проб, які знижують її поверхневий натяг. До них належать проба Гай-Крафта з порошком сірки та проба з метиленовим синім. Збільшення вмісту жовч-них кислот у сечі спостерігається при паренхіматозній і механічній жовтяницях, коли розвивається синдром холемії.
Проба Гай-Крафта. На поверхню сечі в пробірку насипають щіпку сірчаного цвіту в порошку. Якщо сірчаний цвіт не тоне, значить жовчні кислоти відсутні. Швидке занурення сірчаного цвіту на дно пробірки вказує на вміст у сечі більше 0,01 % жовчних кислот.
Проба з метиленовим синім. В одну пробірку наливають дистильовану воду, в другу – сечу. Додають по 1 краплі 0,2 %-ного розчину метиленового синього. При позитивній реакції в пробірці з сечею з’являється зелене забарвлення.
2.6. Визначення вмісту крові
і кров’яних пігментів у сечі
У сечі можуть виявлятися кров і кров’яні пігменти (гемоглобін, метгемоглобін, гемосидерин, сульфогемоглобін), а також м’язовий білок – міоглобін. У сечі здорових тварин мікроскопією осаду можна виявити лише поодинокі еритроцити. Наявність крові в сечі називають гематурією. Візуально домішки крові в сечі (макрогематурію) можна виявити при вмісті в 1 мкл 25 тис. еритроцитів. Сеча в такому випадку набуває червоного кольору і в ній утворюється осад згустку крові.
Якщо кров не змінює колір сечі і її виявляють лише за допомогою хімічних реакцій чи мікроскопії осаду, то це свідчить про розвиток мікрогематурії. Якісне визначення крові та її пігментів проводять за допомогою бензидинової проби та реакції з гваяковим настоєм. Індикаторними смужками можна також визначити кількість крові та її пігментів у сечі, а більш точно концентрацію гемоглобіну визначають геміглобінціанідним методом.
Якісні реакції на кров
2.6.1. Бензидинова проба
Принцип методу. В основі проби лежить здатність пігментів крові забирати кисень від його носіїв і легко передавати його бензидину, який у результаті реакції окиснюється (гемоглобін руйнує водню пероксид, а кисень, що вивільняється, окиснює бензидин).
Приготування реактиву. Невелику кількість бензидину (набирають на кінчик скальпеля) розчиняють у 0,5 мл льодяної оцтової кислоти і до суміші додають 5 мл 3 %-ного розчину водню пероксиду. Реактив готується перед використанням.
Хід визначення. У пробірку наливають 1–2 мл реактиву і обережно піпеткою нашаровують 1–2 мл сечі. За наявності в сечі пігментів крові на межі рідин утворюється смарагдово-зелене кільце, а рідина у пробірці поступово набуває зеленого, а згодом – синього забарвлення. Проба дуже чутлива.
2.6.2. Проба Колло
(з лужним розчином фенолфталеїну)
Приготування лужного розчину фенолфталеїну. 2,0 г фенолфталеїну розчиняють у 100 мл 20 %-ного розчину КОН або NaOH. Розчин кип’ятять і при постійному перемішуванні додають 10,0 г металічного цинку (порошок). Кип’ятіння продовжують до повного знебарвлення розчину. Після охолодження розчин зберігають у флаконі з темного скла.
Хід визначення. У пробірку набирають 1–2 мл сечі, додають 1–2 мл
2 %-ного спиртового розчину оцтової кислоти і 2–3 краплі водню перекису. До цієї суміші додають 5–10 крапель лужного розчину фенолфталеїну. За наявності у сечі крові рідина у пробірці набуває малинового забарвлення. Реакція специфічна і дуже чутлива.
2.6.3. Гваякова проба
Принцип методу. Проба ґрунтується на здатності пігментів крові від’єднувати кисень у його носіїв і передавати гваяковій смолі, що легко окиснюється з утворенням білого кільця на межі двох рідин.
Приготування реактив. 10 крапель 0,5 %-ного спиртового розчину гваякової смоли, приготовленого на 90° етиловому спирті, змішують із 10 краплями озонованої терпентинової олії або 5–6 краплями водню перекису.
Хід визначення. В пробірку набирають 1–2 мл підкисленої і профільтрованої сечі і обережно нашаровують приготовлену суміш. За наявності у сечі крові на межі двох рідин утворюється біле кільце, яке поступово забарвлюється у темно-синій колір. При струшуванні вся суміш забар-влюється у синій колір.
Date: 2015-07-01; view: 511; Нарушение авторских прав