
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Практична робота
|
|
Дослід 1. Визначення ДНК за фосфором.
Принцип методу. Метод грунтується на отриманні вільних нуклеїнових кислот із наступним визначенням кількості ДНК за фосфором, що утворюється у формі фосфату після мінералізації (спалювання) ДНК. Визначення фосфору проводять фотоколориметрично за реакцією з амонію молібдатом за присутності відновника (аскорбінова кислота). Інтенсивність забарвлення продукту реакції – молібденової сині – є пропорційною кількості фосфору у пробі.
Матеріальне забезпечення: Тканина печінки щурів, 1 н розчин натрію гідроксиду (NaOH), 30 % розчин натрію гідроксиду (NaOH), насичений розчин натрію хлориду (NaCl), 20 % розчин ацетатної кислоти (CH3COOH), етиловий спирт, 5 % розчин ТХАК, концентрована сульфатна кислота (H2SO4), 30 % розчин гідрогену пероксиду (Н2О2), стандартний розчин калію дигідрогенфосфату (КН2РО4) 0,01 мг/мл, 2,5 % розчин амонію молібдату ((NH4)2MoO4), 1 % розчин аскорбінової кислоти, центрифуга, ФЕК, пробірки центрифугові, скляні палички, колба К’єльдаля, конічна колба, льодяна баня, пісчана баня.
Хід роботи:
1. Оброблення тканин основою. Наважку тканини печінки масою 100 мг нагрівають з 1 мл 1 н розчину натрію гідроксиду у центрифужній пробірці протягом 15 хв на киплячій водяній бані. Періодично вміст пробірки перемішують скляною паличкою.
2. Послідовне осадження білків і ДНК. Пробу поступово охолоджують за кімнатної температури, а потім за температури 0°С (лід). До охолодженого гідролізату додають 0,5 мл насиченого розчину натрію хлориду у 20 % розчині ацетатної кислоти для осадження білків. Осаджений білок видаляють через 5 хв шляхом центрифугування протягом 5 хв за швидкості 5000 об/хв. Центрифугат зливають у центрифужну пробірку (під час охолодження на льоду), додають до нього 6 мл етилового спирту і витримують протягом 1 год на холоді для повного осадження ДНК. Ще раз центрифугують протягом 5 хв за швидкості 5000 об./хв. Осад ДНК відмивають 5 мл 5% розчину ТХАК.
3. Отримання мінералізату. Осад ДНК кількісно переносять у колбу К’єльдаля, додають 1,5 мл сульфатної концентрованої кислоти і нагрівають (мінералізують) на пісчаній бані до повного освітлення розчину. Для прискорення мінералізації до розчину обережно додають декілька крапель 30 % розчину гідрогену пероксиду (по одній краплі). Після закінчення мінералізації рідину з колби К’єльдаля кількісно (вимірюючи об’єм) переносять у колбу Ерленмеєра. Розчин нейтралізують 30 % розчином натрію гідроксиду за допомогою універсального індикатора. Отриманий мінералізат переносять кількісно у мірну колбу на 50 мл і доводять до позначки дистильованою водою.
4. Визначення ДНК за фосфором. З колби у пробірку відбирають 5 мл розчину, додають 0,5 мл 2,5 % розчину амонію молібдату, 0,5 мл 1 % розчину аскорбінової кислоти і 4 мл дистильованої води. Через 10 хв вимірюють оптичну густину розчину (А) проти води за червоного світлофільтра (довжина хвилі 670 нм) у кюветах завтовшки 5 мм. Вміст фосфору (С) визначають у мкг/мл за калібрувальною кривою.
Для побудови калібрувального графіка використовують стандартні розчини калію дигідрогенфосфату, які містять відповідно 1, 2, 3, 4 мкг фосфору в 1 мл проби. На осі абсцис відкладають значення концентрацій стандартних розчинів фосфору, а на осі ординат – відповідні їм значення оптичної густини.
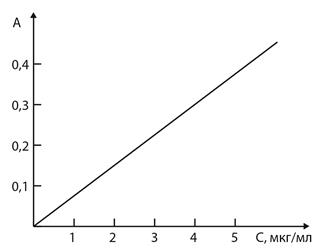
Графік залежності оптичної густини від концентрації фосфору
Концентрацію ДНК визначають у мг% за формулою:
Х = 10 х С, де
Х – вміст ДНК (мг%),
С – концентрація фосфору (мкг/мл),
10– коефіцієнт перерахунку.
Нормальний вміст ДНК у печінці щурів становить 25–35 мг% (мг на 100 г тканини).
Пояснити отриманий результат. Зробити висновок.
Клініко – діагностичне значення. Визначеннякількості ДНК у тканинах пухлини використовують для оцінки прогнозу онкологічних захворювань та можливої індивідуалізації наступного лікування. Крім того, виділюють ДНК з клінічних зразків (біоптати тканин, крапля крові, сперма, слиз жіночих статевих органів, осад сечі, волосся людини, зішкреби епітеліальних клітин тощо) для ланцюгової полімеразної реакції в діагностиці вірусних та спадкових хвороб людини, ідентифікації особини ("ДНК–діагностика") тощо.
При доклінічному експериментальному дослідженні новостворених фармпрепаратів вивчають їх безпосередній вплив як на клітинні органели (ядро, мітохондрії тощо), так і їх компоненти. Тому, в разі отримання субклітинних фракцій клітин, необхідний суворий контроль за їх чистотою і гомогенністю. Однією з головних причин забруднення цитоплазматичних фракцій ядерним матеріалом (а саме, ДНК) є неякісна гомогенізація, що призводить до руйнування ядер. Для оцінки чистоти отриманих цитоплазматичних фракцій у них кількісно визначають ДНК.
Дослід 2. Аналіз екстрактів антибіотиків методом тонкошарової рідинної хроматографії (ТШХ).
Принцип методу ТШХ базується на різниці в швидкості рухливості хімічних сполук у суміші, що є нанесеними на сорбент при їхньому переміщені в потоці рухомої фази (суміш розчинників). В якості сорбентів використовують дрібнозернистий силікагель, Аl2О3, целюлозу, крохмаль, поліамід, тощо. Для тонкошарової рідинної хроматографії антибіотиків використовується суміш розчинників: хлороформ – етанол – метанол - вода у співвідношенні (120:25:6:4,5). Важливо, щоб суміш знаходилась у посудині із щільно закритою притертою кришкою. Суміш готується за добу до виконання досліду для повного насичення посудини парами розчинників.
Матеріальне забезпечення: посудина з розчинниками, силікагелеві пластинка, суміш антибіотиків, мікропіпетки.
Хід роботи:
1. Приготувати силікагелеві хроматографічні пластинки на алюмінієвій основі (Merck UV259). Відступивши 1–1,5 см від нижнього краю, нанести олівцем лінію старту, позначивши через 1 см місця нанесення зразків та підписати їх.
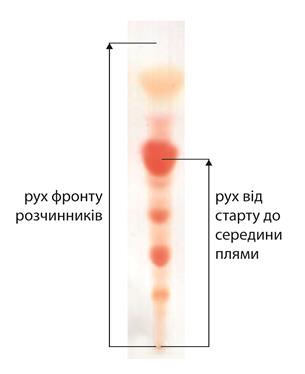 2. Нанести зразки антибіотиків на хроматографічну пластинку, постійно випаровуючи розчинник.
2. Нанести зразки антибіотиків на хроматографічну пластинку, постійно випаровуючи розчинник.
3. Поставити пластинку зі зразками на дно хроматографічної посудини та щільно закрити кришкою.
4. Хроматографічне розділення проводити доти, доки фронт системи розчинників не сягне верхнього краю пластинки.
5. Провести аналіз отриманої хроматограми. Відзначити плями кольорових сполук та порівняти їхнє забарвлення та рухливість (Rf). Визначити на скільки фракцій розділяться окремі зразки. Роздивитися хроматограму в ультрафіолетовому світлі та відмітити олівцем сполуки, які не простежуються при видимому світлі.
 Розміщення зони речовини на хроматографії характеризується значенням Rf, що відповідає відношенню відстані від стартової лінії до центру зони речовини до відстані від стартової лінії до лінії фронту розчинників. Значення Rf є постійною величиною для даної речовини у даній системі розчинників. За цим значенням проводять ідентифікацію компонентів суміші.
Розміщення зони речовини на хроматографії характеризується значенням Rf, що відповідає відношенню відстані від стартової лінії до центру зони речовини до відстані від стартової лінії до лінії фронту розчинників. Значення Rf є постійною величиною для даної речовини у даній системі розчинників. За цим значенням проводять ідентифікацію компонентів суміші.
Контроль виконання лабораторної роботи
1. Пояснити протипухлинну дію антибіотиків. Чи всі антибіотики можуть бути використаними як протипухлинні? Поясніть механізм дій афідиколіну, актиноміцину D.
2. 7. Пояснити молекулярні механізми мутацій. Які найбільш поширені мутагени ви знаєте?
3. На чому грунтується метод отримання ДНК?
4. Який принцип визначення ДНК за фосфором?
5. З мінералізатом ДНК провели реакцію з розчином амонію молібдату і отримали позитивну реакцію – молібденову синь. Який складник ДНК дає позитивну реакцію?
А. Пуринові основи
В. Піримідинові основи
С. Пуринові нуклеозиди
D. Піримідинові нуклеозиди
Е. Фосфатні залишки
6. Похідне уридину – фторурацил, який перетворюється в клітині в фтордезоксиуридилат – сильний незворотній інгібітор тимідилатсинтази. Як пояснити факт пригнічення фторурацилом швидкого поділу ракових клітин у експериментальних тварин?
7. У пацієнта діагностовано пігментну ксеродерму. Його шкіра є надзвичайно чутливою до пошкоджуючої дії сонячного світла. Поясніть причину виникнення цієї патології. Наслідком спадкового порушення синтезу якого УФ–специфічного ферменту є це захворювання?
Приклади тестів „ Крок – 1”
1. Із нітратів, нітритів і нітрозамінів в організмі утворюється азотиста кислота, яка зумовлює окисне дезамінування азотистих основ нуклеотидів. Це може призвести до точкової мутації – заміни цитозину на:
А. Тимін
В. Урацил
С. Аденін
D. Гуанін
E. Інозин
2. У пацієнта діагностовано СНІД. У його лейкоцити потрапила РНК вірусу СНІДу, де за участю ферменту ревертази розпочався синтез вірусної ДНК. Який процес лежить в основі цього процесу?
A. Зворотна транскрипція
B. Зворотна трансляція
C. Репресія оперону
D. Конваріантна реплікація
E. Дерепресія оперону
3. Для лікування урогенітальних інфекцій використовують хінолони – інгібітори ензима ДНК–гірази. Який процес порушується під дією хінолонів насамперед?
А. Ампліфікація генів
В. Реплікація
С. Зворотна транскрипція
D. Репарація
E. Рекомбінація генів
4. В організм людини потрапили іони ртуті. Це призвело до збільшення частоти транскрипції гена, необхідного для детоксикації важких металів. Ампліфікація гена якого білка лежить в основі цього процесу?
А. Металотіонеїну
B. Церулоплазміну
С. Інтерферону
D. Трансферину
E. Феритину
5. Молекулярний аналіз гемоглобіну пацієнта з анемією виявив заміну 6–Глу на 6–Вал у β–ланцюзі. Який молекулярний механізм патології?
А. Генна мутація
В. Хромосомна мутація
С. Геномна мутація
D. Ампліфікація генів
Е. Трансдукція генів
Індивідуальна самостійна робота студентів
1. Сучасні методи дослідження ДНК і РНК, їх клінічне значення.
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – С. 469–544.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 344 - 360.
3. Гонський Я.І., Максимчук Т.П. Біохімія людини. – Тернопіль: Укрмедкнига, 2001. – С. 448–506.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – Львів: Світ, 2006. – 271 с.
5. Біохімічний склад рідин організму та їх клініко-діагностичне значення. Довідник / За ред. Склярова О.Я. – Київ: Здоров’я, 2004. – 191 с.
6. Клінічна біохімія. Курс лекцій для студентів вищих навчальних медичних закладів / За ред. проф. Склярова О.Я. – Львів, 2004. – 295 с.
7. Практикум з біологічної хімії / За ред. О.Я. Склярова. – К.: Здоров’я, 2002. – 297 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 469–502, 511–544.
2. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 64-93.
3. Мушкамбаров Н.Н., Кузнецов С.Л. Молекулярная биология. – М.: ООО «Медицинское информационное агенство», 2003. – 544 с.
4. Фаллер Д.М., Шилдс Д. Молекулярная биология клетки. Руководство для врачей. Пер с англ. М.: БИНОМ-Пресс, 2003.- 272 с.
Змістовий модуль № 13. Основи молекулярної генетики.
Тема № 4. Біосинтез білка у рибосомах. Дослідження процесів ініціації, елонгації та термінації в синтезі поліпептидного ланцюга. Інгібіторна дія антибіотиків. Засвоєння принципів генної інженерії та клонування генів, їх застосування в сучасній медицині.
Мета заняття: Знати загальні закономірності синтезу білків, етапи цього процесу, можливі механізми виникнення та розвитку спадкових захворювань. Засвоїти механізм дії антибіотиків та інших інгібіторів синтезу білків. Знати принципи генної інженерії та клонування генів, їх застосування в сучасній медицині. Засвоїти принцип методу полімеразної ланцюгової реакції в експрес-діагностиці.
Актуальність теми: Білки – це генетично детермінована система, яка генетично запрограмована специфічним набором для кожного індивідуума притаманних тільки йому білкових молекул і з якими пов’язана сутність життя.При вивченні даної теми акцентувати увагу на сучасних досягненнях генної інженерії, в тому числі клонуванні генів, що важливо для вивчення як нуклеотидної послідовності досліджуваного гена, так і послідовності мРНК і білка, які кодуються цим геном. Завдяки генній інженерії здійснено синтез інтерферону людини, людських інсуліну, соматотропіну, соматостатину, білкових препаратів для діагностики СНІДу тощо. Зокрема, в останні роки в діагностиці багатьох захворювань та виявленні бацилоносіїв використовують експрес-метод – полімеразну ланцюгову реакцію.
Конкретні завдання:
Ø Трактувати поняття білок–синтезуючої системи в рибосомах.
Ø Пояснювати механізми функціонування білок-синтезуючої системи за участю ферментів активації амінокислот, ініціації, елонгації та термінації біосинтезу поліпептидних ланцюгів.
Ø Пояснювати біохімічні процеси посттрансляційної модифікації пептидних ланцюгів.
Ø Пояснювати вплив фізіологічно активних сполук й антибіотиків на процеси трансляції.
Ø Пояснювати біохімічні та молекулярно–біологічні принципи методів генної інженерії, технології рекомбінантних ДНК, трансплантації генів та отримання гібридних молекул ДНК.
Ø Пояснювати принципи клонування генів з метою отримання біотехнологічних лікарських засобів.
Теоретичні питання
1. Генетичний (біологічний) код; його властивості. Характеристика таблиці генетичного коду.
2. Рибосомальна білоксинтезуюча система. Компоненти білоксинтезуючої системи рибосом.
3. Будова транспортних РНК та механізм активація амінокислот. Аміноацил–тРНК–синтетази.
4. Етапи та механізми трансляції: ініціація, елонгація, термінація. Ініціюючі та термінуючі кодони мРНК; роль білкових факторів рибосом в трансляції.
5. Регуляція трансляції. Молекулярні механізми контролю трансляції на прикладі біосинтезу глобіну.
6. Механізми посттрансляційної модифікації пептидних ланцюгів.
7. Вплив фізіологічно активних сполук на процеси трансляції. Антибіотики – інгібітори транскрипції та трансляції у прокаріотів та еукаріотів, їх біомедичне застосування.
8. Біохімічні механізми противірусної дії інтерферонів. Блокування біосинтезу білка дифтерійним токсином (АДФ–рибозилювання факторів трансляції).
9. Генна інженерія, або технологія рекомбінантних ДНК: загальні поняття, біомедичне значення. Технологія трансплантації генів та отримання гібридних молекул ДНК; застосування рестрикційних ендонуклеаз. Клонування генів з метою отримання біотехнологічних лікарських засобів та діагностикумів (гормонів, ферментів, антибіотиків, інтерферонів та ін.).
10. Ланцюгова полімеразна реакція; її біомедичне застосування в діагностиці інфекційних та спадкових хвороб людини, ідентифікації особини ("ДНК–діагностика").
Date: 2015-06-11; view: 530; Нарушение авторских прав