
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные принципы лабораторной диагностики малярии.
|
|
Клиническая диагностика
Во многих уголках мира, особенно в гиперэндемичных и голоэндемичных регионах, врачи зачастую ставят предполагаемый диагноз малярии, основываясь исключительно на клинических симптомах. Были предложены различные клинические алгоритмы, и наилучший из них определяет лишь 50% истинных случаев малярии. Он не позволяет дифференцировать малярию, вызваннуе falciparum и vivax плазмодиями. Более того, многие симптомы предполагаемой малярии совпадают с другими заболеваниями, такими как пневмония, отит, тонзиллит и др.
Исследование мазков крови
В настоящее время, несмотря на появление других методов, микроскопическое исследование мазков крови остается "золотым стандартом" для диагностики малярии. Исследования мазка крови позволяет выяснить следующее: 1. инфицирован ли больной 2. вид и стадию жизненного цикла плазмодия 3. уровень паразитемии (количество паразита в 1 мкл крови).
При правильном осуществлении этот метод имеет значительную чувствительность. Порог определения возбудителя при "тонкой капле" составляет 100 паразитов/мкл. Для "толстой капли" этот порог ниже - около 5-20 паразитов/мкл. В обоих случаях точность зависит в основном от опыта микроскописта.
В целом, исследование мазков крови простой и недорогой метод, но все же требует значительную рабочую силу и достаточно времени для просмотра 100 микроскопических полей на каждый мазок. Также необходимы соответствующее оборудование, реактивы и тренированный персонал.
Подробные руководства по сбору крови и подготовке мазка предоставляются со стороны ВОЗ и Центра по контролю и предупреждению заболеваний и могут быть получены с нашей интернет- странички. Имеется также информация о микроскопической картине различных стадий и видов плазмодия ([Интерпретация мазков крови). Каждая клиника в мире имеет свою специфику приготовления кровяных мазков для диагностики малярии, тем не менее существуют общие принципы, которые должны соблюдаться.
Как правило, мазок должен быть приготовлен как можно раньше после взятия венозной крови. Это позволяет предотвратить возможные изменения в морфологии возбудителя и обеспечить хорошее окрашивание. Особое внимание следует обратить на стадию фиксации при приготовление препарата. Необходимо избегать случайной фиксации "толстой капли" метанолом, особенно, если и "толстая капля", и "тонкий мазок" находятся на одном предметном стекле. Исследователь должен дождаться испарения спирта на пальцах исследуемого перед приготовлением "толстой капли". Необходимо избегать фиксации "толстой капли" при одновременном высушивании предметного стекла при помощи искусственного тепла.

Таким образом, до окрашивания "тонкий мазок" фиксируется метанолом; "толстая капля" окрашивается без фиксации. Многие больницы используют краску Райт-Гимзы (Wright-Giemsa), которая вполне приемлема; тем не менее, только краска Райт недостаточно хорошо окрашивает плазмодии. Для лучшего результата мазок должен окрашиваться при помощи 3% раствора Гимзы (pH 7.2) на 30-45 минут.
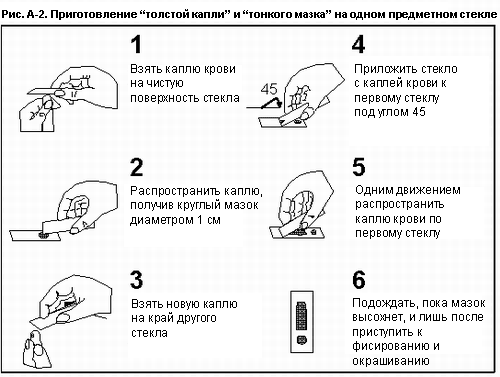
Правильная толщина " толстой капли" может быть оценена при помощи четкости печатного текста, видимого сквозь предметное стекло. Печатный текст должен быть лишь слегка разборчивый. При ограниченности ресурсов, "толстая капля" и "тонкий мазок" могут готовиться на одном предметном стекле. Всегда необходимо исследовать и "толстую каплю", и "тонкий мазок". Оба дают важную информацию для диагностики малярии (Таблица1).
Таблица 1. Характеристика толстой капли и тонкого мазка
| Толстая капля | Тонкий мазок |
| Гемолизированные эритроциты | Фиксированные эритроциты |
| Много слоевs | Один слой |
| Больший объем | Меньший объем |
| Хороший скрининг-тест | Хорошая дифференциация видов |
| Определяет инфекцию даже при низкой паразитемии | Инфекция с низкой паразитемией может быть пропущена |
| Затруднена дифференциальная диагностика видов | Требует больше времени для интерпретации |
Нижеприведенные таблицы могут быть использованы для дифференциации видов плазмодия как на "толстой капле", так и в "тонком мазке" (Таблицы 2-3).
Таблица 2. Дифференциация видов плазмодия в "тонком мазке".
| Признак | P. falciparum | P. vivax | P. ovale | P. malariae |
| Пораженный эритроцит увеличен | + | + | ||
| Форма пораженного эритроцита | округлая | округлая, деформированная | овальная, ворсинчатая | округлая |
| Зернистость эритроцита | пятна Маурэра | пятна Шуффнера | пятна Шуффнера | нет |
| Форма трофозоита | маленькие кольца, поверхностные формы | большие кольца, амебовидные | большие кольца, компактные | маленькие кольца, компактные |
| Зерна хроматина | двойные | единичные | крупные | единичные |
| Зрелый шизонт | редко, 12-30 мерозоитов | 12-24 мерозоитов | 4-12 мерозоитов | 6-12 мерозоитов |
| Гаметоцит | серповидной формы | большой, округлый | большой, округлый | компактный, округлый |
Таблица 3. Дифференциация видов плазмодия в "толстой капле".
| Признак | P. falciparum | P. vivax | P. ovale | P. malariae |
| Однородные трофозоиты | + | |||
| Фрагментированные трофозоиты | ++ | + | ||
| Компактные трофозоиты | + | + | ||
| Пигментированные трофозоиты | + | |||
| Неоднородная цитоплазма | + | + | ||
| Зернистость | + | + | ||
| Шизонты обнаруживаются | крайне редко | часто | часто | часто |
| Гаметоциты обнаруживаются | случайно | обычно | обычно | обычно |
Определение количества циркулирующих возбудителей чрезвычайно важно в клинических целях, для наблюдения за развитием заболевания и эффективностью лечения. Были предложены различные методы:
1. Число паразитов в 1 мкл крови ("толстая капля"): Этот метод требует исследования по возможности большого количества микроскопических полей (иммерсионный окуляр100x), необходимых для подсчета 200 лейкоцитов. Количество бесполых возбудителей и лейкоцитов должно подсчитываться в каждом поле, пока количество лейкоцитов не достигнет 200.

Если количество лейкоцитов неизвестно, предполагается, что они составляют 8000/мкл.
2. Количество паразитов/мкл крови ("тонкий мазок"): Этот метод требует предварительного определения количества эритроцитов, имеющихся в среднем микроскопическом поле.

Количество бесполых форм возбудителя подсчитывается как минимум в 25-и микроскопических полях. Число эритроцитов в среднем микроскопическом поле составляет 200, следовательно, общее количесвтво эритроцитов в 25 полях около 200*25 = 5000. Если гемограмма отсутствует, предполагается, что эритроциты составляют 5.000.000 на мкл для мужчин и 4.500.000 для женщин.
3. Отношение пораженных эритроцитов к общему количеству эритроцитов ("тонкий мазок"): Этот метод определяет процент эритроцитов, инфицированных возбудителями малярии.

Число пораженных эритроцитов (бесполых форм), имеющихся в 25 микроскопических полях, делится на общее количество эритроцитов, имеющихся в этих полях (около 5000), и умножается на 100.
4. Полуколичественное исчисление ("толстая капля"): Это альтернативный метод определения концентрации возбудителя, он более быстрый, но менее точный. Он должен использоваться, только если невозможно использовать более точные методы. Используется следующая шкала.
| + | 1-10 бесполых форм паразита в 100 полях "толстой капли" | |
| ++ | 11-100 бесполых форм паразита в 100 полях "толстой капли" | |
| +++ | 1-10 бесполых форм паразита в одном поле "толстой капли" | |
| ++++ | > 10 бесполых форм паразита в одном поле "толстой капли" |
Необходимо знать, что концентрация возбудителя в крови взаимосвязана с тяжестью клинических проявлений (Таблица 4.).
Таблица4. Соотношение паразитемии и клинического проявления малярии
| Паразитемемия | PПаразиты / мкл | Замечания |
| 0.0001-0.0004% | 5-20 | Чувствительность толстой капли капли |
| 0.002% | В регионах с сезонной малярией, симптомы могут проявляться при паразитемии ниже этого уровня | |
| 0.2% | 10,000 | Выше этого уровня клиника проявляется у лиц с иммунитетом |
| 2% | 100,000 | Максимальная паразитемия при P.vivax и P.ovale |
| 2-5% | 100,000-250,000 | Гиперпаразитемия/тяжелая малярия*, повышенная смертность |
| 10% | 500,000 | Рекомендуется переливание крови/высокая смертность |
| *Согласно ВОЗ критерии тяжелой малярии: паразитемия > 10,000 /мкл и выраженная анемия (гемоглобин < 5 г/л). Прогноз неблагоприятный, если пигментированные трофозоиты и шизонты (преобладают зрелые формы) составляют > 20% паразитов и/если > 5% нейтрофилов содержат видимый пигмент. Hдnscheid T. (1999) Diagnosis of malaria: a review of alternatives to conventional microscopy. Clin Lab. Haem. 21, 235-245. |
Флюоресцентная микроскопия
Этот метод диагностики малярии основан на способности флюоресцентных красок определять РНК и ДНК возбудителя. В качестве напоминания, в норме зрелые эритроциты не имеют ядерного вещества. Поэтому, любое вещество, определяемое флюоресцентным красителем предположительно свидетельствует о наличии плазмодия. Различные методы окраски были созданы для улучшения исследования мазков крови. Метод Кавамото предполагает окрашивание "тонкого мазка" при помощи акридина оранжевого (AO). Этот метод относительно дешевый и имеет высокую чувствительность (до 90%). Тем не менее, он требует сложного оборудования (флюоресцентного микроскопа).
Количественная лейкоцитарная пленка (Quantitative Buffy Coat Assay (QBC®) является другой модификацией флюоресцентной микроскопии. До микроскопии, кровь центрифугируется в пробирках, покрытых АО. Окрашиваются как возбудитель, так и гранулоциты. Тем не менее, под флюоресцентным микроскопом, возбудитель расположен под слоем гранулоцитов в пробирке QBC® метод быстрый и целесообразный при скрининге большого количества образцов. Тем не менее, он требует наличия центрифуги и специальных красителей, а также флюоресцентного микроскопа. Все они стоят дорого. Более того, определение и подсчет видов затруднен.
Серологическая диагностика
Серологические методы основаны на определении антител по отношению к возбудителям малярии. Положительный тест не может различить прошлую и нынешнюю инфекцию и поэтому имеет ограниченную ценность для решений относительно лечения. С другой стороны, отрицательный тест позволяет исключить возможность малярии, поскольку было установлено, что антитела к бесполым возбудителям появляются уже через несколько дней после поражения эритроцитов. Основное применение серологических тестов следующее:
1. Ретроспективное подтверждение эмпирически леченых неиммунизированных лиц
2. Выслеживание асимптоматических инфекций у доноров крови
3. Исследование на наличие врожденной малярии, особенно, если мазки крови матери отрицательные
4. Эпидемиологические исследования для определения регионов передачи малярии и наблюдение за эффективностью профилактических мер.
Определение малярийного антигена
Этот метод диагностики малярии основан на ряде иммунологических проб для определения специфических антигенов. Широко применяются пробы, основанные на определении гистидин-насыщенного белка-2 (ГНБ-2) и паразитарной лактатдегидрогеназы (пЛДГ). В обоих случаях используется иммунохроматографический скорый диагностический тест (СДТ) с кровью.
Эти легко осуществимые тесты были разработаны для быстрой диагностики малярии, вызванной Р. falciparum-ом. Нижеприведенная таблица обобщает признаки 2-х основных серологических методов, используемых в настоящее время (Таблица 5.).

Определение малярийных антигенов ГНБ-2 (А, С) и пЛДГ (В)
Таблица5. Скорые тесты определения малярии
| Признак | PfГНБ-2 тесты | пЛДГ тесты |
| Принцип, лежащий в основе теста |
|
|
| Преимущества |
|
|
| Недостатки |
|
|
| Чувствительность/ специфичность* | Чувствительность 92-100% Специфичность 85- 100% | Чувствительность P.falciparum 88-98% P.vivax 89-94% Специфичность P.falciparum 93-99% P.vivax 99-100% |
| Коммерческая цена/тест** | Приблизительно 0.60-1.00 $США | Приблизительно 2.50$ США |
| Коммерческие продукты |
|
|
* По сравнению с микроскопией
** Меняется в зависимости от поставщика и размера поставки
Полимеразная цепная реакция (PCR)
Этот метод основан на молекулярном биологическом методе для определения генетического материала возбудителя. Он имеет крайне высокую чувствительность. Принцип теста: выявление ничтожно малого количества паразитарной ДНК и увеличние в миллионы раз для более легкого определения. Порог чувствительности составляет 0.05-0.1 паразитов/мкл. Сегодня данный метод позволяет дифференцировать виды плазмодия. Более того, он может быть использован для определения мутацийобуславливающих лекарственную устойчивость возбудителя. Тем не менее,на сегодня этот многообещающий метод используется лишь в больших исследовательских лабораториях. Метод связан с высокой стоимостью и вовлечением обученного персонала. Вероятность загрязнения (ложно-положительный тест) крови остается другим недостатком полимеразной цепной реакции.
Date: 2016-08-31; view: 1366; Нарушение авторских прав