
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Осушка газа, способы осушки
|
|
Водяные пары, содержащиеся в добываемом газе, при определенных термобарических условиях способны конденсироваться, снижая пропускную способность трубопроводов, вызывая коррозию технологического оборудования и опасность гидратных отложений. Предупреждение этих отрицательных явлений обусловливает необходимость осушки газа при его подготовке к транспорту потребителю.
Существует много технологических схем осушки природных газов, разработанных на основе различных методов осушки:
Ø физико-химические, основанные на способности некоторых жидких и твердых веществ поглощать влагу из газа; к ним относятся сорбционные методы — поглощение влаги жидкими (абсорбция) и твердыми (адсорбция) сорбентами;
Ø физические, основанные на охлаждении газового потока с использованием естественной энергии газа или при помощи дополнительного подвода энергии извне;
Ø химические, основанные на химической реакции между молекулами воды и различными веществами.
Химическим методом можно практически полностью удалять пары воды из газового потока, однако в больших объемах газа его не применяют вследствие того, что очень сложно регенерировать используемые дорогостоящие реагенты. Этот метод применяют чаще в лабораторных исследованиях.
Выбор способа осушки определяется требованиями, предъявляемыми к кондиции товарного газа в конкретных условиях. Далее более подробно рассматриваются физико-химические и физические методы осушки газа.
Абсорбция — это избирательное поглощение газов или паров жидкими поглотителями — абсорбентами. В этом процессе происходит переход вещества или группы веществ из газовой или паровой фазы в жидкую. Абсорбция — избирательный и обратимый процесс. Переход вещества из жидкой фазы в паровую или газовую называется десорбцией. Обычно оба процесса объединяются в один производственный процесс.
В процессе десорбции, которую проводят после абсорбции, целевой компонент выделяется из жидкого поглотителя. Очевидно, что условия проведения абсорбции и десорбции прямо противоположны. В процессе абсорбции происходит растворение газа в жидкости, этому способствуют повышение давления и понижение температуры. В процессе десорбции происходит выделение газа из раствора, этому способствуют понижение давления и повышение температуры. Абсорбент, поглотивший в процессе абсорбции целевые компоненты, называется насыщенным, или отработанным. Абсорбент, освобожденный в процессе десорбции от целевых компонентов, называется регенерированным, после охлаждения насосом он может быть снова возвращен на абсорбцию. Таким образом, получается замкнутая абсорбционно-десорбционная система.
Примером абсорбционного процесса может служить гликолевая осушка природного газа. В процессе абсорбции абсорбент поглощает пары воды из природного газа. В процессе десорбции из раствора абсорбента удаляются пары воды, поглощенные из газа. Регенерированный раствор снова возвращается в абсорбер.
Жидкий абсорбент должен удовлетворять ряду требований, основные из которых: высокая влагоемкость, нетоксичность, достаточная стабильность, отсутствие корродирующих свойств, низкая растворяющая способность по отношению к газу и жидким углеводородам и слабая растворимость в них, простота регенерации.
В наибольшей степени этим требованиям отвечают диэтиленгликоль (ДЭГ) и триэтиленгликоль (ТЭГ). Изготовление, упаковка, маркировка, транспортирование, хранение и проверка качества ДЭГ выполняются в соответствии с государственными стандартами. Используя ДЭГ, можно уменьшить температуру точки росы газа примерно на 30 °С. Если температура осушаемого газа такова, что для его осушки требуется большее понижение температуры точки росы, применяют ТЭГ или осушку адсорбцией. Температура кипения ДЭГ при 101,3 кПа равна 245 °С; молекулярная масса 106,12; плотность при 20 °С — 1,12 г/см3; давление насыщенных паров при нормальных условиях — около 0,8 кПа. Температура кипения ТЭГ при давлении 101,3 кПа равна 287 °С; молекулярная масса — 150,17; плотность при температуре 20 °С — 1,25 г/см3; давление насыщенных паров при нормальных условиях 9,3 Па.
На рис. 6.3.1. в качестве примера приведена технологическая схема осушки добываемого нефтяного или природного газа гликолями. Газ проходит сепаратор 7, в котором отбивается капельная влага, затем направляется под нижнюю тарелку абсорбера 2 и движется вверх навстречу гликолю. При контакте с гликолем на тарелках газ осушается и через жалюзийный каплеуловитель 4 выходит за пределы абсорбера. Насыщенный парами воды гликоль достигает нижней части абсорбера, откуда под собственным давлением через теплообменник 16, выветриватель 7 и фильтр 8 направляется в выпарную колонну (десорбер) 12 для восстановления первоначальных свойств (регенерации). Регенерация проводится путем подогрева (за счет сжигания части осушенного газа) раствора гликоля и испарения из него воды в выпарной колонне. Раствор гликоля нагревают до 150 °С (ДЭГ) или до 180 °С (ТЭГ). В верхней части выпарной колонны (десорбера) 12 поддерживают температуру 105— 107 °С. Регенерированный раствор гликоля пропускают через теплообменник 16 и холодильник 11, а затем снова подают на верхнюю тарелку абсорбера 2. Для снижения потерь гликоля при регенерации на выходе из верхней части выпарной колонны (десорбера) 12 установлен холодильник 6, в котором поддерживается температура около 80 °С, и сепаратор для улавливания гликоля 10 с жалюзийным каплеуловителем 4.

Рисунок – 6.3.1. – Принципиальная схема абсорбционной осушки газа
1 – сепаратор; 2 – абсорбер; 3 – линия слива уловленного гликоля; 4 – жалюзийный каплеуловитель; 5 – регулятор уровня; 6 и 11 – холодильник; 7 – выветриватель; 8 – фильтр; 9 – эжектор; 10 – сепаратор для улавливания гликоля; 12 – выпарная колонна (десорбер); 13 – кольца Рашига; 14 – кипятильник (испаритель); 15 – насос; 16 – теплообменник.
Практикой установлено, что для успешной осушки газа в системе должно циркулировать не менее 25 л гликоля на 1 кг абсорбируемой воды при 10 тарелках в абсорбере. Количество свежего раствора, подаваемого на верхнюю тарелку абсорбера, определяется по формуле:

где W — количество поглощаемой из газа воды, т/сут; q1 и q2 —соответственно массовые концентрации гликоля в насыщенном водой и свежем растворе.
Количество воды W, подлежащей поглощению из газа, можно найти по следующей формуле:

где V — количество осушенного газа, м3/сут; W1 и W2 — соответственно начальное и конечное влагосодержание газа, г/м3, определяемое по соответствующей номограмме (рис. 6.3.2.).
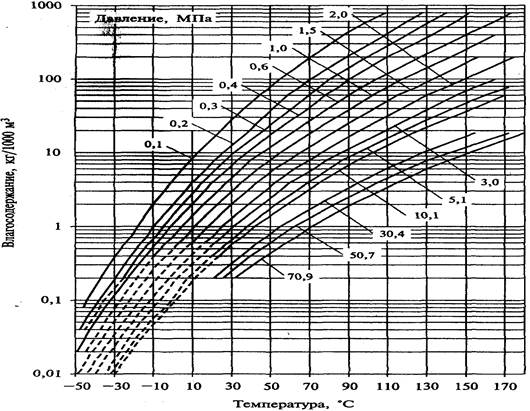
Рисунок – 6.3.2 – Зависимость влагосодержания природного газа с относительной плотностью по воздуху 0,6 от температуры и давления.
Адсорбция — это избирательное поглощение вещества поверхностью твердого поглотителя, называемого адсорбентом. Сущность адсорбции заключается в том, что на огромной удельной поверхности адсорбента (имеющего большое число капиллярных пор, размер которых соизмерим с размерами молекул воды) удерживаются (конденсируются) молекулы воды. Чем больше удельная поверхность (т.е., чем выше пористость) адсорбента, тем больше влаги он может поглощать. Поглощающая способность поверхности объясняется особым состоянием молекул на границе раздела. Внутри фазы каждая молекула испытывает практически одинаковую по всем направлениям силу притяжения других молекул этой фазы. Молекулы же, расположенные на границе раздела фаз, испытывают неодинаковые силы притяжения молекул, находящихся в разных фазах. Если результирующая сила притяжения направлена внутрь данной фазы, то особое состояние ее поверхности проявляется в способности поверхностного слоя притягивать, поглощать молекулы из другой фазы, находящейся в контакте с этим слоем.
При повышении температуры увеличивается энергия адсорбированных молекул, и они могут освобождаться из адсорбента. На этом основан принцип регенерации адсорбентов.
Адсорбция, сопровождающаяся образованием химической связи между молекулами адсорбируемого вещества (адсорбата) и молекулами адсорбента, называется хемосорбцией (химической адсорбцией). Адсорбция, не сопровождающаяся образованием химического соединения, называется физической адсорбцией. Последняя обусловливается силами взаимного притяжения молекул. Эти силы часто называют вандерваальсовыми, а физическую адсорбцию — вандерваальсовой. При физической адсорбции связь адсорбата с адсорбентом менее прочна, чем при хемосорбции. Изменение внешних условий процесса (давления и температуры) ведет к нарушению связи между молекулами адсорбата и адсорбента, и начинается процесс десорбции — удаление молекул адсорбата с поверхности адсорбента.
В качестве адсорбентов (поглотителей) применяются твердые вещества, имеющие большую удельную поверхность, отнесенную обычно к единице массы вещества. Удельная поверхность адсорбентов колеблется от сотен до десятков сотен квадратных метров на грамм в зависимости от вида и сорта адсорбента. В технике широко применяются адсорбенты с удельной поверхностью 600 — 800 м2/г.
Одна из важнейших характеристик адсорбента — его адсорбционная емкость или количество вещества, которое может быть поглощено единицей массы, или объема адсорбента при данных условиях адсорбции. Адсорбционная емкость выражается в %, г/г, г/100 г. Адсорбционную емкость иногда по-другому называют активностью адсорбента. Один и тот же адсорбент по отношению к различным веществам обладает разной активностью. Адсорбционная (поглотительная) активность адсорбентов зависит также от внешних условий адсорбции (давления, температуры и концентрации адсорбата в потоке).
Количество вещества, поглощаемое адсорбентом, определяется состоянием равновесия. Количественно процесс адсорбции в условиях равновесия принято представлять графически изотермой адсорбции, выражающей связь количества вещества, адсорбированного единицей массы или объема адсорбента, с концентрацией адсорбата в газовой или жидкой фазе при постоянной температуре процесса.
Промышленные адсорбенты должны удовлетворять следующим требованиям:
Ø иметь большую адсорбционную емкость;
Ø обладать высокой селективностью;
Ø обладать способностью к регенерации;
Ø иметь высокую механическую прочность;
Ø обладать стабильностью адсорбционных свойств в условиях длительной эксплуатации;
Ø быть нетоксичными, не вызывать коррозию;
Ø иметь низкую стоимость.
При выборе адсорбента для промышленного использования приходится отдавать предпочтение тем или иным из перечисленных требований. В газовой промышленности для осушки газов и жидкостей применяют: активированную окись алюминия, алюмогели, силикагели и цеолиты (молекулярные сита); для очистки от кислых компонентов — цеолиты; для извлечения из газа углеводородных компонентов — активированные угли и силикагели. Адсорбционные свойства адсорбентов существенно зависят от способа их приготовления и активации.
Примерами применения адсорбции могут служить: извлечение жидких углеводородов из потоков газа, содержащих мало тяжелых компонентов, активированным углем; удаление воды из газа силикагелем или алюмогелем; удаление меркаптанов молекулярными ситами и т. п.
Характеристика некоторых распространенных адсорбентов приведена в табл. 6.3.1.
Таблица 6.3.1.
Date: 2016-07-25; view: 3123; Нарушение авторских прав