
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Дефекты кристаллического строения металлов
|
|
Атомно-кристаллическая структура металлов
Под атомно-кристаллической структурой понимают взаимное расположение атомов, существующее в кристалле. Кристалл состоит из атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях. Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки. Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой располагаются атомы (ионы), образующие металл (твердое кристаллическое тело).
Металлы образуют одну из следующих высокосимметричных сложных решеток с плотной упаковкой атомов: кубическую объемно-центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно-центрированной решетке атомырасположены в узлах ячейки и один атом – в центре объема куба. Кубическую объемно-центрированную решетку имеют следующие металлы: Rb, К, Na, Li, Та, W, V, Feα, Cr, Nb, Ba и др.
В кубической гранецентрированной решетке атомы расположены в углах куба и в центре каждой грани.Этот тип решетки имеют металлы Pb, Sc, Ni, Ag, Au, Pd, Pt, Rh, Cu и др.
В гексагональной решетке атомы расположены в углах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Эту упаковку атомов имеют металлы Hf, Mg, Cd, Re, Os, Ru, Zn, Be, La, и др.
Размеры кристаллической решетки характеризуются величинами периодов, под которыми понимают расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку. Период решетки металлов находится в пределах от 1 до 7 Å.
Дефекты кристаллического строения металлов
Дефекты кристаллического строения подразделяют по геометрическим признакам на точечные (нуль-мерные), линейные (одномерные) и поверхностные (двухмерные).
Точечные дефекты. Эти дефекты малы во всех трех измерениях, и размеры их не превышают нескольких атомных диаметров. К точечным дефектам относятся вакансии, или «дырки» (дефекты Шотки), т. е. узлы решетки, в которых атомы отсутствуют. Вакансии чаще образуются в результате перехода атомов из узлов решетки на поверхность (границу зерна, пустоты, трещины и т. д.) или их полного испарения с поверхности кристалла и реже в результате перехода в междоузлие. В кристалле всегда имеются атомы, кинетическая энергия которых значительно выше средней, свойственной данной температуре нагрева. Такие атомы, особенно расположенные вблизи поверхности, могут выйти на поверхность кристалла, а их место займут атомы, находящиеся дальше от поверхности, а принадлежавшие им узлы окажутся свободными, т. е. возникнут тепловые вакансии. С повышением температуры концентрация вакансий возрастает. Количество вакансий при температуре, близкой к плавлению, может достигать 1% по отношению к числу атомов в кристалле. (Быстрым охлаждением от данной температуры можно зафиксировать эти вакансии при нормальной температуре (закалка вакансий)). Возможно образование не только одиночных вакансий, но и двойных, тройных и более крупных.

|
| Кристаллическая решетка: а - кубическая объемно-центрированная (о. ц. к.); б - кубическая гранецентрироаанная (г. ц. к.); в — гексагональная плотноупакованная (г. п. у.) |

|
| Точечные дефекты |
Вакансии образуются и в процессе пластической деформации, а также при бомбардировке металла атомами или частицами высоких энергий (облучение в циклотроне или нейтронное облучение в ядерном реакторе).
Межузсльные атомы (дефекты Френкеля). Эти дефекты образуются в результате перехода атома из узла решетки в междоузлие. На месте атома, вышедшего из узла решетки в междоузлие, образуется вакансия. В плотноупакованных решетках, характерных для большинства металлов, энергия образования межузельных атомов в несколько раз больше энергии образования тепловых вакансий. Вследствие этого в металлах очень трудно возникают межузельные атомы, и тепловые вакансии в таких кристаллах являются основными точечными дефектами. (в меди при 1000°С концентрация межузельных атомов на 35 порядков меньше концентрации вакансий.)
Точечные несовершенства кристаллической решетки появляются и в результате действия атомов примесей, которые, как правило, присутствуют даже в самом чистом металле. Точечные дефекты вызывают местное искажение кристаллической решетки. Смещения (релаксация) вокруг вакансий возникают только в первых двух слоях соседних атомов и составляют доли межатомного расстояния. Вокруг межузельного атома в плотноупакованных решетках смещение соседей значительно больше, чем вокруг вакансий.
Линейные дефекты. Линейные несовершенства имеют малые размеры в двух измерениях и большую протяженность в третьем измерении. Эти несовершенства называются дислокациями. Краевая дислокация представляет собой локализованное искажение кристаллической решетки, вызванное наличием в ней «лишней» атомной полуплоскости или экстраплоскости, перпендикулярной к плоскости чертежа.

|
Наиболее простой и наглядный способ образования дислокаций в кристалле – сдвиг (рис. 9, а). Если верхнюю часть кристалла сдвинуть относительно нижней на одно межатомное расстояние, причем зафиксировать положение, при котором сдвиг охватывает не всю плоскость скольжения, а только часть ее ABCD, то граница АВ между участком, где скольжение уже произошло, и не нарушенным участком в плоскости скольжения и будет дислокацией. Линия краевой дислокации перпендикулярна вектору сдвига.
Кроме краевых различают еще винтовые дислокации. Винтовые дислокации в отличие от краевых располагаются параллельно направлению сдвига (линия AD). При наличии винтовой дислокации кристалл можно рассматривать как состоящий из одной атомной плоскости, закрученной в виде винтовой поверхности. Дислокации окружены полями упругих напряжений, вызывающих искажение кристаллической решетки. В краевой дислокации выше края экстраплоскости межатомные расстояния меньше нормальных, а ниже края – больше.
Дислокации не могут обрываться внутри кристаллита. Они могут прерываться на других дислокациях или на границах раздела (границы зерен, поверхность кристалла и т. д.). В связи с этим внутри кристалла дислокации образуют замкнутые петли или взаимосвязанные сетки.
Под плотностью дислокаций понимают суммарную длину дислокации l, приходящуюся на единицу объема V кристалла n = Σ l / V. Таким образом, размерность плотности дислокаций (см-2).
Поверхностные дефекты. Представляют собой поверхности раздела между отдельными зернами или их блоками (субзернами) поликристаллического металла. Каждое зерно металла состоит из отдельных блоков, или субзерен, образующих так называемую мозаичную структуру, или субструктуру. Зерна металла обычно разориентированы относительно друг друга на величину, достигающую от нескольких долей градуса (малоугловые границы) до нескольких градусов или нескольких их десятков (высокоугловые границы).
Блоки, или субзерна, повернуты по отношению друг к другу на угол от нескольких секунд до нескольких минут (малоугловые границы), имеют размеры на три-четыре порядка величины меньше размеров кристаллитов (10-6 – 10-4 см). В пределах каждого блока, или субзерна, решетка почти идеальная, если не учитывать точечных несовершенств.
(1′ = 1/60 угловых градусов; α[°] = (180 / π) × α[рад], где: α[рад] — угол в радианах, α[°] — угол в градусах).
Границы между отдельными кристаллитами (зернами) представляют собой переходную область шириной в 5–10 межатомных расстояний, в которой решетка одного кристалла, имеющего определенную кристаллографическую ориентацию, переходит в решетку другого кристалла, имеющего иную кристаллографическую ориентацию.

|
| схема зерна и блочной структуры |
На границе зерна атомы расположены менее правильно, чем в объеме зерна. По границам зерен в технических металлах концентрируются примеси, что еще больше нарушает правильный порядок расположения атомов.
Границы блоков, а также малоугловые границы зерен образованы дислокациями. В реальном поликристаллическом металле протяженность границ блоков и зерен очень велика, количество дислокаций в таком металле огромно (104 – 1012 см-2). Атомы на границах зерен (или субзерен) имеют повышенную потенциальную энергию. Такую повышенную энергию имеют и атомы, расположенные на поверхности кристалла, вследствие нескомпенсированности сил межатомного взаимодействия.
Твердые растворы
В сплавах в зависимости от физико-химического взаимодействия компонентов могут образовываться следующие фазы: жидкие растворы, твердые растворы, химические соединения.
В зависимости от того, по какому типу размещаются атомы в твердом растворе, различают три вида твердых растворов:
1) твердые растворы замещения;
2) твердые растворы внедрения;
3) твердые растворы вычитания.
Твердые растворы замещения, образуются путем замены атомов растворителя в его кристаллической решетке атомами растворенного компонента. При этом оказывается, что в большинстве случаев любой из атомов растворителя, расположенный в узлах кристаллической решетки, может быть замещен атомом растворенного компонента.
Условия образования твердых растворов замещения с неограниченной растворимостью:
1) Металлы должны обладать одинаковым типом кристаллических решеток. (Только в этом случае при изменении концентрации твердого раствора будет возможен непрерывный переход от кристаллической решетки одного компонента к решетке другого компонента. В противном случае, т. е. при различных типах кристаллических решеток, неизбежен разрыв этой непрерывности с образованием твердого раствора на базе компонента с иной кристаллической решеткой.) Этому условию удовлетворяют в большинстве случаев металлы, расположенные в одних и тех же группах периодической системы Менделеева.
2) Твердые растворы с неограниченной растворимостью могут образовываться лишь в том случае, когда электронная концентрация или остается ниже критической, или сохраняется неизменной при любой концентрации твердых растворов. (Под электронной концентрацией следует понимать отношение числа валентных электронов к числу атомов сплава. Если, например, сплав состоит из меди и цинка, в котором содержится 64 атомных % Сu и 36 атомных % Zn, то общее количество валентных электронов, приходящихся на 100 атомов сплава будет 64 ·1 + 36 · 2 = 136 электронов. Электронная концентрация 136/100=1,36.) Та или иная кристаллическая решетка твердого раствора может существовать в устойчивом состоянии лишь до определенной концентрации электронов. Электронная концентрация, при которой достигается предел устойчивости кристаллической решетки, называется критической. Теоретический расчет показывает, что критическая электронная концентрация для кубической гранецентрированной кристаллической решетки составляет 1,36, а для объемноцентрированной – 1,48 электронов на атом. Полной растворимости компонентов можно ожидать в случае, когда электронная концентрация или не изменяется от добавления сплавляемого компонента, или уменьшается.
( Наклонные линии 1 — 0, 1 — 1, 1 — 2, 1—3, 1 — 4, 1 — 5 показывают изменение электронной концентрации при образовании твердого раствора в одновалентном металле при добавлении элементов с валентностью 0, 1, 2, 3, 4, 5. Критическая электронная концентрация показана в виде горизонтальной линии, проходящей на уровне 1,36. Совершенно очевидно, что критическая электронная концентрация не может быть достигнута при растворении в одновалентном металле, имеющем гранецентрированную решетку, элементов с нулевой или единичной валентностью, и между сплавляемыми металлами следует ожидать образования непрерывного ряда твердых растворов. При добавлении двухвалентного металла и образовании твердого раствора критическая электронная концентрация достигается при 36 атомных процентах. Для трехвалентного, четырехвалентного и пятивалентного металлов критическая электронная концентрация достигается соответственно при 18, 12 и 9 атомных процентах.)

|
| Зависимость растворимости от электронной концентрации твердых растворов |
3) Для образования непрерывного ряда твердых растворов при соблюдении условия электронной концентрации и однотипности структуры кристаллических решеток необходимо, чтобы диаметры атомов отличались не больше, чем на 14 – 15 %. В сплавах на основе железа образование неограниченных твердых растворов имеет место только тогда, когда атомные диаметры растворяемых элементов отличаются от атомного диаметра железа не более чем на 8 %. Если различие атомных диаметров находится в пределах от 8 до 15 %, образуются ограниченные твердые растворы
(В ряде случаев соблюдение всех этих 3 условий, однако, не обеспечивает полной растворимости. Это связано с тем, что замена атомов растворителя атомами растворенного металла ведет к изменению параметра кристаллической решетки и удельного объема сплава. Медь не дает неограниченных твердых растворов с железом и кобальтом, Серебро – с кобальтом и никелем.)
Неограниченно растворяются в твердом состоянии следующие металлы с г. ц. к. решеткой: Ag и Аu (ΔR = 0,2%), Ni и Сu (ΔR = 2,7%), Ni и Rd (ΔR = 10,5%) и др., а также металлы с о. ц. к. -решеткой: Мо и W (ΔR = 9,9%), V и Ti (ΔR = 2,0%).
Следует отметить:
1. Металл с высокой валентностью обладает большей растворимостью в металле с низкой валентностью, чем металл с низкой валентностью в металле с высокой валентностью.
2. При заданной температуре растворимость больше в том металле, температура плавления которого ниже.
Упорядочные твердые растворы (« Материалы со спец св-ми» )
В некоторых сплавах (например, Сu и Аu, Fe – Al, Fe – Si, Ni – Mn и др.), образующих при высоких температурах растворы замещения (с неупорядоченным чередованием атомов компонентов), при медленном охлаждении или длительном нагреве при определенных температурах протекает процесс перераспределения атомов, в результате которого атомы компонентов занимают определенные положения в кристаллической решетке. (Полностью упорядоченные растворы образуются, когда отношение компонентов в сплаве (ат. %) постоянно: 1:1, 1:2, 1:3 и т. д. В этом случае сплаву с упорядоченной структурой можно приписать формулу химического соединения, например CuAu или Cu3Au. Упорядоченные твердые растворы можно рассматривать, как промежуточные фазы между твердыми растворами и химическими соединениями. В упорядоченных твердых растворах в отличие от химического соединения сохраняется решетка растворителя, и при нагреве до определенной температуры (точки Курнакова) степень упорядочения постепенно уменьшается, а выше этой температуры твердый раствор становится неупорядоченным.)
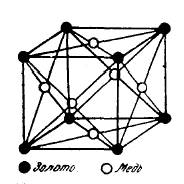
| 
|
| Элементарная ячейка решетки сплава с 75% Сu и 25% Аu с упорядоченным расположением атомов, соответствующим химическому соединению Сu3Au | Элементарные ячейки решетки с 50% Аu и 50% Сu с упорядоченным;расположением атомов, соответствующим химическому соединению CuAu. |
Date: 2016-07-25; view: 932; Нарушение авторских прав