
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теория отталкивания сигма-связывающих и не поделенных электронных пар и ее применение для описания геометрической конфигурации молекул и ионов
|
|
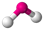
Теория отталкивания электронных пар валентных орбиталей (ОЭПВО) — один из подходов в химии, необходимый для объяснения и предсказания геометрии молекул. Согласно этой теории молекула всегда будет принимать форму, при которой отталкивание внешних электронных пар минимально (принцип минимума энергии)
| Тип молекулы | Конфигурация | Расположение электронных пар† | Геометрия‡ | Примеры |
| AX1En | Двухатомная | 
| 
| HF, O2 |
| AX2E0 | Линейная | 
| 
| BeCl2, HgCl2, CO2 |
| AX2E1 | Искаженная | 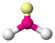
| 
| NO2−, SO2, O3 |
| AX2E2 | Искаженная | 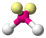
| 
| H2O, OF2 |
| AX2E3 | Линейная | 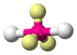
| 
| XeF2, I3− |
| AX3E0 | Равносторонний треугольник | 
| 
| BF3, CO32−, NO3−, SO3 |
| AX3E1 | Тригональная пирамида | 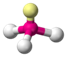
| 
| NH3, PCl3 |
| AX3E2 | Т-образная | 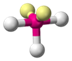
| 
| ClF3, BrF3 |
| AX4E0 | Тетраэдр | 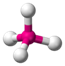
| 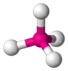
| CH4, PO43−, SO42−, ClO4− |
| AX4E1 | Дисфеноид («Качели») | 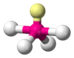
| 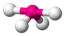
| SF4 |
| AX4E2 | Плоскоквадратная геометрия | 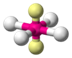
| 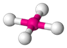
| XeF4 |
| AX5E0 | Тригональная бипирамида | 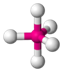
| 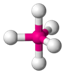
| PCl5 |
| AX5E1 | Квадратная пирамида | 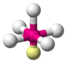
| 
| ClF5, BrF5 |
| AX6E0 | Октаэдр | 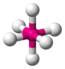
| 
| SF6 |
| AX6E1 | Пентагональная пирамида | 
| 
| XeF6 |
| AX7E0 | Пентагональная бипирамида | 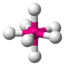
| 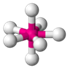
| IF7 |
Структура периодической системы элементов: периоды, группы, подгруппы, вставные декады. Взаимосвязь между электронной структурой атомов элементов и их положением в периодической системе.
Периодическая таблица и электронные конфигурации атомов. В настоящее время известно более 500 вариантов изображения периодической системы: это различные формы передачи периодического закона.Первым вариантом системы элементов, предложенным Д. И. Менделеевым 1 марта 1869 г., был так называемый вариант длинной формы. В этом варианте периоды располагались одной строкой. В декабре 1870 г. он опубликовал второй вариант периодической системы — так называемую короткую форму. В этом варианте периоды разбиваются на ряды, а группы — на подгруппы (главную и побочную).В периодической системе по горизонтали имеется 7 периодов, из них первые три называются малыми, а остальные — большими. В первом периоде находится 2 элемента, во втором и третьем — по 8, в четвертом и пятом — по 18, в шестом — 32, в седьмом (незавершенном) — 21 элемент. Каждый период, за исключением первого” начинается щелочным металлом и заканчивается благородным газом (7-й период — незаконченный).Все элементы периодической системы пронумерованы в том порядке, в каком они следуют друг за другом. Номера элементов называются порядковыми или атомными номерами. В системе 10 рядов. Каждый малый период состоит из одного ряда, каждый большой период — из двух рядов: четного (верхнего) и нечетного (нижнего). В четных рядах больших периодов (четвертом, шестом, восьмом и десятом) находятся одни металлы, и свойства элементов в ряду слева направо изменяются слабо. В нечетных рядах больших периодов (пятого, седьмого и девятого) свойства элементов в ряду слева направо изменяются, как у типических элементов Основным признаком, по которому элементы больших периодов разделены на два ряда, является их степень окисления. Их одинаковые значения дважды повторяются в периоде с ростом атомных масс элементов. Например, в четвертом периоде степени окисления элементов от К до Mn изменяются от +1 до +7, затем следует триада Fe, Со, Ni (это элементы четного ряда), после чего наблюдается такое же возрастание степеней окисления у элементов от Cu до Br (это элементы нечетного ряда). То же мы видим в остальных больших периодах, исключая седьмой, который состоит из одного (четного) ряда. Дважды повторяются в больших периодах и формы соединений элементов.В шестом периоде вслед за лантаном располагаются 14 элементов с порядковыми номерами 58-71, называемых лантаноидами (слово “лантаноиды” означает подобные лантану”, а “актиноиды” — “подобные актинию”). Иногда их называют лантанидами и актинидами, что означает следующие за лантаном, следующие за актинием). Лантаноиды помещены отдельно внизу таблицы, а в клетке звездочкой указано на последовательность их расположения в системе: La-Lu. Химические свойства лантаноидов очень сходны. Например, все они являются реакционно-способными металлами, реагируют с водой с образованием гидроксида и водорода. Из этого следует, что у лантаноидов сильно выражена горизонтальная аналогия. В седьмом периоде 14 элементов с порядковыми номерами 90-103 составляют семейство актиноидов. Их также помещают отдельно — под лантаноидами, а в соответствующей клетке двумя звездочками указано на последовательность их расположения в системе: Ас-Lr. Однако в отличие от лантаноидов горизонтальная аналогия у актиноидов выражена слабо. Они в своих соединениях проявляют больше различных степеней окисления. Например, степень окисления актиния +3, а урана +3, +4, +5 и +6. Изучение химических свойств актиноидов крайне сложно вследствие неустойчивости их ядер.В периодической системе по вертикали расположены восемь групп (обозначены римскими цифрами). Номер группы связан со степенью окисления элементов, проявляемой ими в соединениях. Как правило, высшая положительная степень окисления элементов равна номеру группы. Исключением являются фтор — его степень окисления равна -1; медь, серебро, золото проявляют степень окисления +1, +2 и +3; из элементов VIII группы степень окисления +8 известна только для осмия, рутения и ксенона.В VIII группе размещены благородные газы. Ранее считалось, что они не способны образовывать химические соединения. Каждая группа делится на две подгруппы — главную и побочную, что в периодической системе -подчеркивается смещением одних вправо, а других влево. Главную подгруппу составляют типические элементы (элементы второго и третьего периодов) и сходные с ними по химическим свойствам элементы больших периодов. Побочную подгруппу составляют только металлы — элементы больших периодов. VIII группа отличается от остальных. Кроме главной подгруппы гелия она содержит три побочные подгруппы: подгруппу железа, подгруппу кобальта и подгруппу никеля. Химические свойства элементов главных и побочных подгрупп значительно различаются. Например, в VII группе главную подгруппу составляют неметаллы F, С1, Вг, I, Аt, побочную — металлы Мn, Тc, Rе. Таким образом, подгруппы объединяют наиболее сходные между собой элементы.Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения, форм таких соединений 4. Их также изображают общими формулами в последовательности RН4, RН3, RН2, RН. Формулы водородных соединений располагаются под элементами главных подгрупп и только к ним относятся.Свойства элементов в подгруппах закономерно изменяются: сверху вниз усиливаются металлические свойства и ослабевают неметаллические. Очевидно, металлические свойства наиболее сильно выражены у франция, затем у цезия; неметаллические — у фтора, затем — у кислорода. Период – горизонтальный ряд, имеющий одинаковое число электронных слоев, номер периода совпадает со значением главного квантового числа n внешнего уровня (слоя); таких периодов в периодической системе семь. Второй и последующие периоды начинаются щелочным элементом (ns 1) и заканчивается благородным газом (ns 2 np 6). По вертикали периодическая система подразделяется на восемь групп, которые делятся на главные – А, состоящие из s - и p -элементов, и побочные – B-подгруппы, содержащие d -элементы. Подгруппа III B, кроме d -элементов, содержит по 14 4 f - и 5 f -элементов (4 f - и 5 f -семейства). Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы. В главных подгруппах валентные электроны (электроны, способные образовывать химические связи) расположены на s - и p -орбиталях внешнего энергетического уровня, в побочных – на s -орбиталях внешнего и d -орбиталях предвнешнего слоя. Для f -элементов валентными являются (n – 2) f - (n – 1) d - и ns -электроны. Сходство элементов внутри каждой группы – наиболее важная закономерность в периодической системе. Следует, кроме того, отметить такую закономерность, как диагональное сходство у пар элементов Li и Mg, Be и Al, B и Si и др. Эта закономерность обусловлена тенденцией смены свойств по вертикали (в группах) и их изменением по горизонтали (в периодах). Все сказанное выше подтверждает, что структура электронной оболочки атомов элемента изменяется периодически с ростом порядкового номера элемента. С другой стороны, свойства определяются строением электронной оболочки и, следовательно, находятся в периодической зависимости от заряда ядра атома. Далее рассматриваются некоторые периодические свойства элементов.
Date: 2016-07-20; view: 605; Нарушение авторских прав