
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Поняття про аксонний транспорт
|
|
Функціонування синапсів тісно пов’язане з аксонним транспортом.
Аксонний транспорт – це транспорт речовин і окремих органоїдів по аксону від тіла нейрона до нервового закінчення і навпаки.
Види аксонного транспорту:
- швидкий аксонний транспорт. Це транспорт від тіла нейрона до нервового закінчення. Він здійснюється зі швидкістю 5-15 мм/год за участі нейрофібрил і мікро- трубочок, потребує енергії АТФ та іонів Са2+;
- повільний аксонний транспорт. Рух речовин від тіла нейрона до нервового закінчення, який не потребує енергії. Його швидкість 1-3 мм/добу;
- ретроградний аксонний транспорт. Це транспорт речовин від нервового закінчення до тіла нейрона зі швидкістю 2,5-7,5 мм/год (приблизно у 2 рази повільніше, ніж швидкий аксонний транспорт).
Значення аксонного транспорту:
1 Потрібний для функціонування синапсів. Від тіла нейрона до нервової терміналі транспортуються:
- ферменти синтезу медіаторів;
- порожні синаптичні пухирці, які утворюються в апараті Гольджі;
- мітохондрії, які необхідні для енергозабезпечення синаптичного процесу.
2 Забезпечує нервову трофіку - обмін речовин у тканині, яку іннервує. Вважають, що за допомогою аксонного транспорту транспортуються речовини – регулятори обміну речовин у периферичних клітинах.
3 Впливає на функціонування тіла нейрона. Ретроградний аксонний транспорт забезпечує надходження у тіло нейрона факторів, які регулюють тут процеси біосинтезу білків. Якщо перерізати аксон, то у тілі нейрона розвиваються деструктивні зміни, які отримали назву хроматоліз.
4 Бере участь у розвитку деяких хвороб. Так, ретроградний транспорт забезпечує надходження в тіло нейрона деяких типів вірусів і бактеріальних токсинів, що має значення у патогенезі поліомієліту, герпесу, сказу, правця.
Механізм функціонування нервово-м’язових синапсів
Передача інформації через нервово-м’язовий синапс пов’язана з такими послідовними подіями:
1 Синтез ацетилхоліну (АХ)
Здійснюється у цитозолі нервових терміналей.

Депонування АХ
АХ транспортується всередину синаптичних везикул, де зберігається у висококонцентрованій формі. Кожна везикула містить близько 10 тис. молекул АХ.
3 Вивільнення АХ у синаптичну щілину
Розрізняють спонтанне та індуковане потенціалом дії вивільнення.
Спонтанне вивільнення характеризується тим, що у стані спокою окремі випадкові синаптичні везикули зливаються з пресинаптичною мембраною і вивільнюють АХ, який у них міститься, у синаптичну щілину. Кожна везикула вивільнює певну кількість АХ, яка називається “квантом”. Результатом спонтанного вивільнення АХ є виникнення на постсинаптичній мембрані так званих мініатюрних потенціалів кінцевої пластинки.
Основним механізмом, що має функціональне значення, є вивільнення АХ, індуковане потенціалом дії. Цей механізм можна подати у вигляді такої схеми:

4 Дія ацетилхоліну на постсинаптичну мембрану
Вивільнившись у синаптичну щілину, АХ взаємодіє з ацетилхоліновими рецепторами постсинаптичної мембрани, які знаходяться у заглибинах субсинаптичних складок.
Ацетилхоліновий рецептор являє собою іонний канал, ворота якого відкриваються ацетилхоліном (хемочутливий канал). Цей рецептор складається з 5 білкових субодиниць, що утворюють трубкоподібний канал, який проходить наскрізь плазматичної мембрани.
У стані спокою канал закритий. Як тільки до рецептора приєднується ацетилхолін, з білками відбуваються конформаційні зміни, які призводять до відкриття каналу.
Відкритий ацетилхоліновий канал має діаметр 0,65 нм, що дає йому змогу пропускати через себе позитивно заряджені іони Na+, К+, Са2+. Негативні іони (наприклад, Cl-) не проходять через канал, оскільки його початок має заряд “-“.
Провідне фізіологічне значення має вхід Na+ через канал у м’язове волокно, оскільки існує дуже великий електрохімічний градієнт для усіх іонів.
Вхід Na+ із синаптичної щілини у м’язове волокно через ацетилхоліновий канал-рецептор призводить до локальної деполяризації постсинаптичної мембрани - виникає потенціал кінцевої пластинки (ПКП).
Якщо ПКП досягає критичного рівня, то викликає ПД, який поширюється по обидва боки м’язового волокна. У нормі ПКП у 3-4 рази вищий, ніж необхідно для виникнення ПД.
Таким чином, дію АХ на постсинаптичну мембрану можна подати у вигляді такої схеми:

При спонтанному виділенні квантів АХ зміни мембранного потенціалу постсинаптичної мембрани незначні. Вони отримали назву мініатюрних потенціалів кінцевої пластинки. Їх амплітуда дорівнює приблизно 1 мВ, а тривалість - декілька мс. Природно, такі потенціали не можуть викликати розвиток ПД.
Якщо у синаптичну щілину вивільнюється багато АХ, він діє протягом кількох сотень мс, і мембрана, яка була спочатку деполяризована, поступово реполяризується, незважаючи на постійну присутність АХ. Рецептори стають рефрактерними до АХ, тобто інактивуються. Втрата чутливості рецепторів до дії медіатора отримала назву десенситизації.
5 Завершення дії АХ
У нормі дія АХ на постсинаптичну мембрану продовжується 1-2 мс. Чому? Це пояснюється двома обставинами:
1 Більша частина АХ зазнає гідролітичного розщеплення, яке здійснюється ферментом холінестеразою у матриксі симпатичної щілини.

2 Менша частина АХ дифундує із синаптичної щілини в оточуючу тканину, а потім - у кров, де також підлягає гідролізу за участі холінестерази плазми.
6 Реутилізація продуктів гідролізу АХ і відновлення кількості синаптичних везикул
Продукти гідролізу АХ - холін і ацетат – реабсорбуються із синаптичної щілини у нервову терміналь. Так вони знову використовуються для синтезу АХ.
Після вивільнення АХ мембрана синаптичних везикул стає частиною пресинаптичної мембрани. Через кілька секунд після цього починається ендоцитоз: із пресинаптичної мембрани шляхом її втягування формуються везикули. Втягування мембрани обумовлено скороченням білка катрину, прикріпленого до внутрішньої поверхні мембрани. Везикули зливаються, що призводить до утворення цистерн. Поступово від цистерн починають відділятися синаптичні везикули, що заповнюються ацетилхоліном.
Патофізіологічні аспекти нервово-м’язової передачі
Порушення передачі імпульсів з нерва на м’яз називається блокадою нервово-м’язової передачі.
Основними причинами блокади нервово-м’язової передачі є:
1 Механічне ушкодження нервів, яке призводить до:
- порушення проведення ПД до нервових терміналей – порушується імпульсна активність нерва;
- розладів аксоплазматичного транспорту – порушується неімпульсна активність нерва.
2 Токсини і отрути:
- ботулінічний токсин – екзотоксин Clostridium botulinum;
- зміїна отрута -
 -бунгаротоксин;
-бунгаротоксин; - кураре – екстракт, який отримують із рослин Strychnos i Chondodendron, що ростуть у Південній Америці (ця отрута використовувалася здавна, наприклад, індійцями для обробки стріл);
- інсектициди – речовини, що використовують у боротьбі з комахами. Це фосфорорганічні сполуки: хлорофос, дихлофос, карбофос та ін.;
- бойові отруйні речовини: зарин, зоман.
3 Фармакологічні препарати, які використовують з лікувальною і профілактичною метою. (див. нижче).
4 Спадкові фактори.
Прикладом є захворювання Myasthenia gravis. Хвороба спостерігається з частотою 1: 20 000. Проявляється м’язовою слабістю і швидкою втомлюваністю у зв’язку з порушенням нервово-м’язової передачі.
Основні механізми блокади нервово-м’язової передачі:
1 Порушення проведення збудження до пресинаптичних нервових закінчень (див. вище).
2 Порушення аксоплазматичного транспорту, які можуть бути обумовлені:
- механічним ушкодженням нерва (в експерименті використовують перетин нерва – денервацію);
- порушенням мікротрубочок (в експерименті їх індукують деякими отрутами – колхіцином, вінбластином);
- дефіцитом енергії, яка необхідна для здійснення швидкого аксонного транспорту. Існує припущення, що цей механізм важливий для розвитку нервових розладів при бері-бері (гіповітамінозу В1) і алкогольній інтоксикації (алкогольний поліневрит).
3 Порушення синтезу і депонування АХ у нервових терміналях. Причинами яких можуть бути:
- дефіцит вихідних продуктів синтезу АХ – ацетилКоА і холіну. Недостатність ацетилКоА може бути пов’язана з розладами катаболічних перетворень глюкози (наприклад, при бері-бері). Недостатність холіну може бути пов’язана з порушеннями його надходження у нервові клітини із крові, з розладами його надходження із синаптичної щілини;
- дефіцит або порушення активності ферменту холінацетилтрансферази;
- недостатність синаптичних везикул. Її причиною можуть бути порушення утворення везикул в апараті Гольджі тіла нейрона, їх транспорту до нервових терміналей, порушення утворення везикул із пресинаптичної мембрани.
- порушення транспорту АХ із аксоплазми у синаптичні пухирці.
4 Порушення вивільнення АХ у синаптичну щілину.
- In vitro моделюється видаленням з розчину Са2+ або внесенням у розчин Mg2+ чи Mn2+, які є конкурентами Са2+.
- In vitro вивільнення АХ порушує ботулінічний токсин, який блокує потенціалозалежні кальцієві канали, що призводить до розладів екзоцитоз.
5 Порушення ацетилхолінових рецепторів постсинаптичної мембрани:
- зменшення кількості ацетилхолінових рецепторів. Наприклад, при Myasthenia gravis у хворих виявляються аутоантитіла проти цих рецепторів. Спочатку рецептори блокуються, потім руйнуються;
- блокада ацетилхолінових рецепторів. Вона може бути необоротною (дія
 -бунгаротоксину) і оборотною (дія кураре);
-бунгаротоксину) і оборотною (дія кураре); - інактивація (десенситизація) ацетилхолінових рецепторів. Цей стан характеризується тим, що у синаптичній щілині є достатня кількість ацетилхоліну, але рецептори до нього не чутливі. Це може бути при тривалій деполяризації постсинаптичної мембрани, яка є наслідком тривалої дії АХ. Такий механізм блокади характерний для фосфорорганічних сполук – інгібіторів холінестерази (інсектициди, бойові отруйні сполуки).
6 Порушення енергетичного обміну. За умов цих порушень страждають усі процеси, що потребують енергії, а саме:
- проведення ПД до пресинаптичної мембрани;
- синтез і утворення ферментів, везикул, мітохондрій;
- швидкий аксонний транспорт;
- транспорт АХ із аксоплазми у синаптичні везикули;
- екзоцитоз АХ;
- ендоцитоз (новоутворення синаптичних везикул із пресинаптичної мембрани);
- захват нервовими терміналями продуктів гідроліза АХ (холіна і ацетата).
Незалежно від причин і механізмів розвитку, клінічно блокада нервово-м’язової передачі виявляється м’язовою слабістю, м’язовою втомлюваністю, паралічами м’язів. Найбільш важким проявом є периферична зупинка дихання, яка пов’язана порушенням скорочення дихальної мускулатури.
Фармакологічні аспекти нервово-м’язової передачі
З лікувальною метою часто приходиться втручатися в механізми нервово-м’язової передачі за допомогою лікарських засобів.
Існує 2 групи препаратів, які впливають на цей процес:
1 Міорелаксанти. Це речовини, які використовують під час наркозу з метою запобігти рефлекторним скороченням скелетної мускулатури.
За механізмом дії розрізняють:
- деполяризуючі міорелаксанти (сукциніл, холін, дитилін) – викликають тривалу деполяризацію постсинаптичної мембрани, в результаті чого розвивається інактивація (десенситизація) ацетилхолінових рецепторів і нервово-м’язова блокада;
- недеполяризуючі міорелаксанти (тубокурарин, диплацин, меликрин) – блокують ацетилхолінові рецептори, внаслідок чого АХ не може викликати ПД.
2 Інгібітори холінестерази – ацетилхолінестеразні препарати. Ці препарати зворотної (фізостигмін, прозерін) і незворотної (фосфакол) дії. Ці препарати інактивують холінестеразу, збільшують вміст АХ в синаптичній щілині. Їх використовують при міастенії, а також в якості антагоністів блокаторів ацетилхолінових рецепторів, наприклад для припинення дії недеполяризуючих міорелаксантів після операції.
ФІЗІОЛОГІЯ М’ЯЗОВОГО СКОРОЧЕННЯ
Взаємодія людини із зовнішнім середовищем не може здійснюватися без скорочення його м’язів. Рухи, які при цьому відбуваються, необхідні для виконання найпростіших маніпуляцій, а також для висловлювання думок і почуттів за допомогою мови, письма, міміки, жестів.
Маса м’язів становить 50% маси тіла (з них 40% - скелетні м’язи, 10% - серцевий м’яз і гладенькі м’язи).
Функціональна анатомія скелетних м’язів
М’язове волокно, як і кожна клітина, має мембрану – сарколему, ендоплазматичний ретикулум – саркоплазматичний ретикулум, мітохондрії, саркоплазму. А його особливою рисою є наявність міофібрил. Міофібрила складається з пучків “ниток” – міофіламентів (тонких – актинових і товстих – міозинових).

Будова м’язового волокна.
Міофібрила ділиться Z-пластинками на кілька частин – компартментів, які називаються саркомерами. Тобто саркомер - це ділянка міофібрили між двома Z-лініями. У розслабленому м’язі довжина саркомера становить 2,0 - 2,5 мкм.
За допомогою світлового мікроскопа у саркомері розрізняють світлі і темні смуги. Така поперечна смугастість міофібрил обумовлена особливим взаємним розміщенням актинових і міозинових філаментів. По центру кожного саркомера знаходиться кілька тисяч «товстих» ниток міозину, кожна діаметром близько 10 нм. Пучок міозинових ниток у центрі саркомера виглядає у світловому мікроскопі темною смугою. Завдяки властивості подвійного заломлення світла (анізотропії), ця ділянка саркомера називається анізотропним диском (А-диском). У центрі А-диск містить ділянку, в якій не перекриваються актинові і міозинові філаменти, яка складається тільки з міозинових філаментів. Ця ділянка А-диска називається Н-зоною. У центрі Н-зони розрізняють тонку темну М-лінію, до якої кріпляться «товсті» міозинові філаменти. По кінцях саркомера розміщені «тонкі» нитки актину, які прикріплені до Z-пластинок. У світловому мікроскопі ці ділянки міофібрили виглядають світлими смугами і називаються ізотропними дисками (І-дисками).
Саме внаслідок такого чергування світлих і темних смуг у саркомерах міофібрили серцевого і скелетного м’яза виглядають поперечно смугастими. Структура саркомера схематично зображена на рисунку.

Структура саркомера.
Молекулярні механізми м’язового скорочення
Молекулярні механізми скорочення м’язів пояснює теорія Хакслі-Хансона – теорія “ковзання” міофібрил (Huxley H.E., Hanson J., 1954)
Основні положення цієї теорії:
- Скорочення міофібрил відбувається внаслідок скорочення великої кількості саркомерів.
- Під час скорочення довжина “тонких” актинових і “товстих” міозинових філаментів не змінюється.
- Процес скорочення відбувається в результаті ковзання актинових філаментів вздовж міозинових.
- Процес м’язового скорочення потребує енергії АТФ.
Під час скорочення м’язів під світловим мікроскопом спостерігаються такі зміни:
- зменшується довжина саркомера;
- зменшується довжина І-дисків;
- зменшується довжина Н-зони;
- довжина А дисків не змінюється.
Під час розслаблення м’язів відбуваються протилежні зміни:
- збільшується довжина саркомера;
- збільшується довжина І-дисків;
- збільшується довжина Н-зони;
- довжина А дисків не змінюється.
Для розгляду сучасного стану теорії скорочення потрібно з’ясувати молекулярну структуру актинових і міозинових філаментів.
Структура міозинових і актинових філаментів
Міозинові філаменти – це товсті філаменти довжиною 1,6 мкм. Вони складаються з білка міозину (молекулярна маса близько 500 000).
Молекула міозину складається з двох важких (молекулярна маса 200 000) і чотирьох легких (молекулярна маса 20 000) поліпептидних ланцюгів. Два важкі ланцюги об’єднуються у спіраль (так званий ” хвіст” молекули). На кінці важкі ланцюги закручуються і разом з легкими утворюють дві голівки. Таким чином, у молекулі міозину виділяють хвіст і дві голівки.

Структура молекули міозину.
Для утворення однієї міозинової філаменти потрібно 200 молекул білка міозину. Молекули міозину переплітаються своїми хвостами і утворюють так званий стрижень філаменти, від якого відходять поперечні містки, які складаються з голівки і шийки.

Структура міозинової філаменти.
Властивості поперечних містків:
- Голівки здатні зв’язуватися з активними центрами актинових філаментів.
- Голівки мають АТФ-азну активність (АТФ-аза міозину активується актином за наявності іонів Mg2+ і гідролізує АТФ до АДФ і неорганічного фосфату Рн з виділенням енергії).
- Голівки здатні згинатись у місці з’єднання із шийкою. Це місце являє собою своєрідний шарнірний механізм. Згинаючись, голівка переміщує зв’язану з нею актинову філаменту вздовж стосовно міозинового стрижня.
Актинові філаменти – це тонкі філаменти довжиною 1 мкм і товщиною 5-7 нм. Вони складаються з трьох білків:
- актину;
- тропоміозину;
- тропоніну.

Структура актинової філаменти.
Актин складає основу актинової філаменти. Дві нитки актину-полімеру (F-актину) закручені у подвійну спіраль. Кожна нитка F-актину складається з багатьох молекул актину-мономера (G-актину), молекулярна маса якого становить 42 000. По суті, нитка F-актину нагадує намисто, де намистинка - молекула G-актину. Кожна молекула G-актину містить активний центр для зв’язування з міозином (зв’язування здійснюється через AДФ, яка фактично є містком між актином і міозином).
Тропоміозин - фібрилярний білок (молекулярна маса 70 000, довжина 40 нм), закручений у спіраль разом з двома нитками F-актину. У стані спокою, коли м’язове волокно розслаблене, тропоміозин розміщений так, що закриває активні центри актину (одна молекула тропоміозину закриває 7 активних центрів), і взаємодія між голівками міозину і активними центрами актину неможлива (рис. 9.6 А). Таким чином, тропоміозин відіграє роль білка, що є блокатором активних центрів актину.
Тропонін – глобулярний білок, який складається з трьох субодиниць:
- Тропонін І – має високу спорідненість з актином;
- Тропонін Т – має високу спорідненість з тропоміозином;
- Тропонін С – має високу спорідненість з іонами Са2+.
Тропонін є білком, що регулює взаємодію тропоміозину з актином.
Коли концентрація іонів Са2+ у цитоплазмі низька, розміщення тропоніну таке, що тропоміозин блокує активні центри актину. Скорочення неможливе (рис. А).


А Б
При зростанні концентрації іонів Са2+ в саркоплазмі м’язового волокна, ці іони взаємодіють з тропоніном С
(1 молекула тропоніну зв’язує 4 іони Са2+). У результаті цієї взаємодії змінюється конформація тропоніну, тропоміозин занурюється вглиб актинової фітаменти і активні центри актину звільнюються. Скорочення стає можливим (рис. Б).
Молекулярні механізми м’язового скорочення
При зростанні концентрації іонів Са2+ у саркоплазмі м’язового волокна Са2+ взаємодіє з тропоніном С, і тропоміозин вивільнює активні центри актину (рис. Б). Голівки міозину взаємодіють з АТФ, гідролізують її до АДФ і (Рн) з вивільненням енергії. Продукти гідролізу (АДФ і Рн) деякий час залишаються зв’язаними з голівками міозину, що необхідно для приєднання голівки до активного центру актину (АДФ відіграє роль своєрідного містка між актином і міозином). Вивільнена енергія акумулюється в шарнірному механізмі шийки поперечного містка (як у пружині, що розтягнута). Голівка стає в перпендикулярне положення до актинової філаменти і взаємодіє з активним центром.

Механізм ковзання актинових філаментів.
Зв’язування голівки з активним центром спричиняється до згинання голівки у шийці завдяки попередньо акумульованій енергії розтягнення (як скорочення попередньо розтягнутої пружини). При цьому голівка, що згинається, тягне за собою прикріплену актинову філаменту і зміщує її по стосовно міозинової філаменти.
У голівці, що зігнулася, молекула АТФ витісняє АДФ і Рн, тому зв’язок між нею і активним центром актину руйнується. Як тільки відбулося відщеплення голівки від активного центру, АТФ гідролізується до АДФ та Рн, і завдяки вивільненій енергії голівка розгинається (як розтягується пружина), стає перпендикулярно і зв’язується з наступним центром актину. Зазначений цикл повторюється знову і знову.

Принцип роботи поперечного містка.
Актинова філамента пересувається вздовж міозинової до центру саркомера. Описаний принцип роботи поперечного містка отримав назву – принцип “весла”. Його основу складають 2 циклічні процеси:
- утворення і руйнування актоміозинових комплексів;
- згинання і розгинання голівок поперечних містків.
Рух великої кількості голівок створює об’єднане зусилля (своєрідний “гребок”), яке просуває актинові нитки до середини саркомера. За один “гребок” саркомер зменшується на 1% своєї довжини.
Якщо йдеться про скорочення саркомера, то слід мати на увазі таке:
- поперечні містки протилежних частин міозинових філаментів мають різний напрямок орієнтації. Тому при згинанні-розгинанні голівок актинові філаменти від різних Z- пластинок саркомера переміщуються назустріч одна одній і довжина саркомера при цьому зменшується;
- згинання–розгинання голівок відбувається асинхронно, незалежно одна від одної (одні зігнуті, інші розігнуті). Чим більша синхронність цього процесу, тим більша сила скорочення. Іншими словами, чим більша кількість контактів поперечних містків з актином у кожний даний момент часу, тим більша сила скорочення.
Етапи м’язового скорочення
Процес скорочення скелетних м’язів ініціюється імпульсом, який виникає в  -мотонейронах передніх рогів спинного мозку.
-мотонейронах передніх рогів спинного мозку.
Процес скорочення складається з 4 основних етапів:
1-й етап – збудження мембрани м’язового волокна і поширення ПД вздовж мембрани.
Нервова терміналь волокна, яке іннервує м’яз, вивільнює медіатор ацетилхолін, під дією якого виникає потенціал кінцевої пластинки. Цей ПД поширюється по мембрані м’язового волокна в обох напрямках.
Характеристика ПД, що виникає в скелетних міоцитах:
- ПС = - 80 -90 мВ;
- тривалість ПД = 1-5 мс;
- швидкість поширення = 3-5 м/с.
2-й етап – електромеханічне спряження.
Електромеханічне спряження (спряження між збудженням і скороченням) - це передача сигналу про скорочення від сарколеми до міофібрил. Тобто перехід процесу збудження мембрани м’язового волокна у скорочення міофібрил.
У спряженні беруть участь 3 типи структур:
1 Поперечні Т-трубочки - інвагінації сарколеми, які розміщені перпендикулярно до сарколеми і до міофібрил. У середині Т-трубочок міститься рідина, яка за складом є ідентичною позаклітинній рідині. У ссавців на один саркомер припадає дві Т-трубочки на рівні кінців міозинових філаментів. Мембрани Т-трубочок здатні проводити ПД, що надходить до них по сарколемі.
2 Термінальні цистерни – це розширені частини саркоплазматичного ретикулума (СПР), що контактують із Т-трубочками.
3 Поздовжні трубочки – це витягнуті вздовж мембрани компоненти СПР.
Термінальні цистерни і поздовжні трубочки не сполучаються із позаклітинним середовищем. Їх основна функція – депонування іонів Са2+.
Одна поперечна Т-трубочка і дві прилеглі до неї цистерни називаються тріадою.
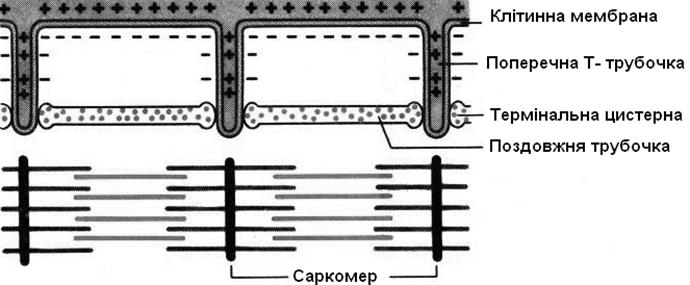
Тріада.
Електромеханічне спряження відбувається таким чином:
- Проведення збудження по Т-системі. ПД поширюється із сарколеми на мембрану Т-трубочок, що призводить до деполяризації цієї мембрани. У місцях контакту Т-трубочок із термінальними цистернами деполяризація передається на мембрани СПР.
- Вивільнення іонів Са2+ із термінальних цистерн і поздовжніх Т-трубочок у саркоплазму. Деполяризація мембрани СПР спричиняється до швидкого відкриття Са-каналів мембрани цистерн і поздовжніх трубочок. Через відкриті Са-канали іони Са2+ за градієнтом концентрації швидко виходять із структур СПР у саркоплазму.
- Дія іонів Са2+ на міофібрили. Внаслідок виходу іонів Са2+ із СПР концентрація цього іона у саркоплазмі зростає у 100 – 1000 разів (у стані спокою концентрація Са2+ у саркоплазмі становить 10-8 М, а під час скорочення – 10-6 – 10-5 М). Са2+ взаємодіє із тропоніном С, і тропоміозин вивільнює активні центри актину.
3-й етап – власне скорочення.
З відкриттям активних центрів актину починається процес скорочення – ковзання актинових філаментів вздовж міозинових до центру саркомера з використанням АТФ.
4-й етап – розслаблення.
Процес розслаблення міофібрил пов'язаний з відновленням тропоміозинового блока активних центрів актину. Це відбувається при зменшенні концентрації іонів Са2+ у саркоплазмі до вихідного рівня (10-8М). Цей процес пов'язаний з такими механізмами:
- Робота Са-насосів мембран СПР. Са-насоси – це білки, які вмонтовані у мембрану СПР і мають АТФ-азну активність. Збільшення концентрації Са2+ під час скорочення до 10-6–10-5 М спричиняється до активації Са-насосів, які починають активний транспорт іонів Са2+ проти градієнта концентрації із саркоплазми у СПР.
- Зв’язування Са2+ із кальсеквестрином (білком СПР).
Зменшення концентрації Са2+ у саркоплазмі призводить до зміни конформації Тропініну і відновлення тропоміозинових блоків. Активні центри актину не здатні взаємодіяти з голівками міозину, і скорочення припиняється.
Енергетичне забезпечення м’язового скорочення
Процес м’язового скорочення є процесом енергозалежним. У м’язовому волокні АТФ використовується на такі процеси:
- роботу Nа-К-насосів сарколеми (Nа-К-АТФ-ази). Завдяки цьому механізму забезпечується збудливість м’язового волокна, підтримується потенціал спокою;
- просторове переміщення поперечних містків міозину (голівки міозину містять фермент АТФ-азу). Завдяки цьому забезпечується, власне, процес скорочення - ковзання актинових філаментів вздовж міозинових;
- роботу Са-насоса СПР (Са-АТФ-аза). Завдяки цьому механізму забезпечується процес розслаблення м’язового волокна.
Структурами, що використовують АТФ, є сарколема, міофібрили, СПР.
Джерелами АТФ в міоцитах є:
- креатинфосфат (КФ). Це макроергічна сполука, концентрація якої у клітині становить 30 ммоль/л.
КФ + АДФ  К + АТФ.
К + АТФ.
Ця реакція забезпечує швидке поповнення запасів АТФ. Кількість креатинфосфату в клітині невелика, тому за рахунок цього джерела м’яз може скорочуватися протягом 7-8 секунд;
- анаеробне (безкисневе) окиснення глікогену і глюкози (глікогеноліз і гліколіз). Цей шлях забезпечує скорочення м’яза тривалістю до 1 хвилини;
- аеробне окиснення вуглеводів, жирів, амінокислот. Реакції окиснення відбуваються у мітохондріях, потребують великої кількості кисню. Цей шлях забезпечує тривале скорочення м’язів і є основним джерелом АТФ.
Date: 2016-11-17; view: 786; Нарушение авторских прав