
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Сумарний ПД нервового стовбура
|
|
Закони подразнення
І Закон силових відношень (закон сили)
Чим більша сила подразника, тим більша (до певних меж) і біологічна реакція.

Закон силових відношень.
0 - 1 – допороговий діапазон сил.
1 – мінімальна сила подразника, здатна викликати мінімальну реакцію - поріг подразнення.
Для збудливих структур характерна така закономірність: чим менший поріг подразнення, тим більша збудливість структури і навпаки.
1 – 2 – субмаксимальний діапазон сил, в якому працює закон силових відношень.
2 – максимальна сила подразника, здатна спричиняти найбільшу реакцію.
2 - 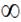 супермаксимальний діапазон сил.
супермаксимальний діапазон сил.
У цьому діапазоні сил можливі такі варіанти відповіді біологічних структур:
а - зберігається максимальна відповідь;
б - інтенсивність біологічної реакції знижується;
в - біологічна структура руйнується, будь-яка відповідь відсутня.
ІІ Закон “все або нічого”
На дію підпорогового подразника біологічна структура не відповідає (“нічого”). На дію подразника порогової сили виникає відразу максимальна відповідь (“все”). Подальше збільшення сили подразника не спричиняє посилення біологічної реакції.
Закон “все або нічого”.
ІІІ Закон тривалості подразнення (закон “сили часу”)
Чим більша сила подразника, тим менше часу потрібно для того, щоб виникла біологічна реакція.

Закон “сили часу”.
ФІЗІОЛОГІЯ КЛІТИНИ. ФУНКЦІОНАЛЬНІ ВЛАСТИВОСТІ КЛІТИННОЇ МЕМБРАНИ
Елементарною біологічною одиницею є клітина. На рівні клітини забезпечується самостійне існування і виконання всіх основних біологічних функцій. Більшість фізіологічних процесів у клітині відбуваються за участі мембран. Мембрани у клітині виконують такі функції:
· Структурну. Створюють структуру клітини та її органоїдів.
· Ізолюючу. Забезпечують вибіркову проникність клітини до речовин.
· Створюють градієнти концентрації речовин між відповідними структурами та середовищем, що їх оточує.
· Регулюють активність процесів, що відбуваються у певних структурах і клітині в цілому.
Клітинна мембрана (плазмалема) – це мембрана, що відділяє вміст клітини від позаклітинної рідини. Її товщина 7,5 - 10 мкм.
Будова клітинної мембрани
Сучасною моделлю клітинної мембрани є рідинно-мозаїчна модель, запропонована у 1972 році Зінгером і Ніколсоном. Автори моделі називали мембрану «ліпідним морем, в якому плавають білкові айсберги».
Отже, відповідно до мозаїчної моделі мембрана складається з таких компонентів:
· ліпідного компонента (42%);
· білкового компонента (55%);
· вуглеводного компонента (3%).

Рідинно-мозаїчна модель клітинної мембрани
Ліпідний компонент складає основу мембрани. Він виконує дві основні функції:
1 бар’єрну функцію (розмежування внутрішньоклітинного вмісту клітини від її мікрооточення, транспорт речовин);
2 матричну функцію (служить матрицею, в якій перебувають численні мембранні білки).
Ліпідна плівка являє собою подвійний шар ліпідів, так званий бішар, який представлений фосфоліпідами і холестеролом.
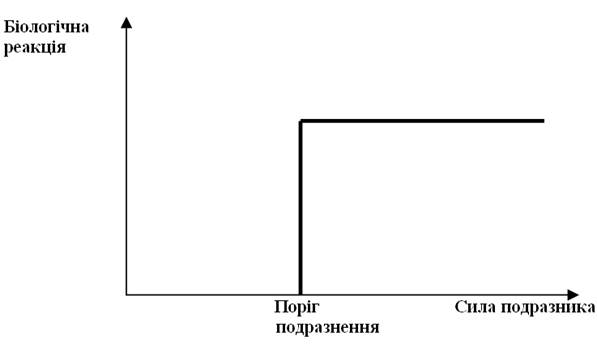
Молекула фосфоліпідів складається з гідрофільної голівки і гідрофобних хвостів. Голівка становить ¼ молекули фосфоліпіду. Вона може бути негативно зарядженою або нейтральною (частіше нейтральна, оскільки нейтральні голівки легше упаковуються у плівку, а негативні відштовхуються). До складу голівки входять азотиста основа і фосфорна кислота. Хвости становлять ¾ довжини фосфоліпіду. Одна молекула фосфоліпіду має два хвости. До складу хвостів входять вищі жирові кислоти - насичені (пальмітинова, стеаринова) і ненасичені (лінолева, ліноленова, арахідонова).
Схематичне зображення молекули фосфоліпіду
Фосфоліпідна плівка – це рідина, яка для нормального функціонування повинна мати певну в’язкість. У нормі в’язкість мембрани дорівнює в’язкості оливкової олії. Нормальна в’язкість забезпечується певним співвідношенням насичених і ненасичених жирових кислот: насичені збільшують в’язкість, ненасичені зменшують.

Формула фосфоліпіду
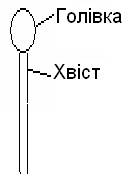
Фосфоліпіди у складі клітинної мембрани не закріплені жорстко. Вони рухаються або у межах одного моношару (латеральна дифузія), або із одного моношару в інший (фліп-флоп).

А Б
Види рухів фосфоліпідів у мембрані: А – латеральна дифузія, Б – фліп-флоп.
Холестерол – одноатомний спирт, похідне циклопентанпергідрофенантрену. Його молекула не містить довгих прямих ланцюгів, а складається із 4 кілець. Молекула холестеролу, як і інші ліпідні молекули має полярну і неполярну частини, тому добре вбудовується в ліпідні ансамблі клітинних мембран. Плазматичні мембрани містять досить значну кількість холестеролу. Наприклад, у плазматичних мембранах клітин печінки він становить близько 30% усіх мембранних ліпідів.

Формула холестеролу
Значення холестеролу для функціонування мембран дуже різнобічне.
· Холестерол регулює агрегатний стан біліпідної плівки. Якщо щільність клітинної мембрани зростає, він розріджує її. Якщо мембрана стає рідкою, він, навпаки, робить її більш густішою.
· Холестерол є мембранним амортизатором. Ліпідні ланцюги бішару знаходяться в упорядкованому стані, тому випадкові рухи одного з них неминуче передаються іншим. Холестерол, вбудовуючись між фосфоліпідами, блокує цю передачу, тому кооперативні рухи швидко затухають, і в мембрані зберігається порядок.
· Холестерол надає мембрані електроізоляційних властивостей.
Білковий компонент. Молекули мембранних білків наче айсберги плавають у ліпідний матриці мембрани. Їх поділяють на 2 групи:
1 Інтегральні білки – це білки, які проходять наскрізь мембрани (за хімічною структурою це переважно глікопротеїни).
2 Периферичні білки – це білки, які не проникають в середину мембрани, а лише прикріпляються до її внутрішньої чи зовнішньої поверхні.
Функції мембранних білків:
· транспортна. Здійснення транспорту речовин через мембрану забезпечується білками-каналами, білками-переносниками і білками-насосами;
· каталітична. Каталіз біохімічних реакцій виконується, як правило, периферичними білками: ендоферментами, які діють на внутрішній поверхні мембрани, і ектоферментами, які діють на зовнішній її поверхні;
· рецепторна. В її основі лежить специфічна взаємодія мембранних білків з різними лігандами: медіаторами, біологічно активними речовинами, гормонами, імуноглобулінами, компонентами комплементу та ін;
· антигенна. Полягає у здійсненні імунних реакцій;
· структурна. Білки забезпечують підтримання певної структури клітин. Наприклад, спектрин, глікофорин та ін.;
· здійснення міжклітинних взаємодій забезпечується адгезивними білками, інтегрином, селектином та ін.
Вуглеводний компонент клітинної мембрани представлений глікокаліксом, який складається з вуглеводних залишків мембранних глікопротеїдів і гліколіпідів, а також позаклітинними протеогліканами. Товщина глікокаліксу становить приблизно 50 нм. Вуглеводи глікокаліксу мають велику кількість аніонних груп, що і обумовлює їх основні функції.
Функції глікокаліксу:
· створює назовні клітини негативний заряд. Завдяки такому заряду між клітинами, що перебувають у рідині (наприклад, у крові), діють сили відштовхування, і вони не прилипають одна до одної;
· забезпечує міжклітинні взаємодії. У тканинах глікокалікс однієї клітини може зливатися з глікокаліксом іншої, утворюючи міжклітинні контакти;
· депонування позаклітинних катіонів, зокрема, Са2+. Завдяки поліаніонному характеру глікокаліксу, він може зв’язувати великі кількості Са2+ і, таким чином, служити його депо.
Основні відмінності хімічного складу вмісту клітини і позаклітинної рідини.
Існують істотні відмінності у хімічному складі внутрішньоклітинного середовища і позаклітинної рідини:
| Позаклітинна рідина | Внутрішньоклітинна рідина | |
| Na+ | 142 мекв/л | 10 мекв/л |
| K+ | 4 мекв/л | 140 мекв/л |
| Ca2+ | 2,4 мекв/л | 0,0001 мекв/л |
| Mg2+ | 1,2 мекв/л | 58 мекв/л |
| Cl- | 103 мекв/л | 4 мекв/л |
| HCO3- | 28 мекв/л | 10 мекв/л |
| РО43- | 4 мекв/л | 75 мекв/л |
| SO42- | 1 мекв/л | 2 мекв/л |
| білки | 5 мекв/л | 40 мекв/л |
| глюкоза | 90 мг% | від 0 до 20 мг% |
| амінокислоти | 30 мг% | 200 мг% |
| рО2 | 35 мм рт. ст. | 20 мм рт. ст. |
| рСО2 | 46 мм рт. ст. | 50 мм рт ст. |
| рН | 7,4 | 7,0 |
Через клітинну мембрану здійснюється постійний обмін речовин між внутрішньоклітинним та позаклітинним секторами. Основу цього обміну складають механізми транспорту речовин через клітинну мембрану.

Везикулярний транспорт – це транспорт речовин за допомогою везикул. У залежності від напрямку він буває двох видів:
· ендоцитоз (транспорт у клітину);
· екзоцитоз (транспорт із клітини).
Розрізняють два види ендоцитозу:
− фагоцитоз (поглинання твердих речовин);
− піноцитоз (поглинання рідких речовин у вигляді крапель).

Ендоцитоз
Речовина, що поглинається, наближається до поверхні клітинної мембрани і абсорбується на ній. Потім мембрана втягується всередину і її краї змикаються. У результаті утворюється ендоцитозний пухирець, який відривається від мембрани і мігрує всередину клітини (рис.2.7). Найчастіше ендоцитозні пухирці об’єднуються в один великий пухирець і зливаються з лізосомою, яка містить ферменти для перетравлення речовин, що транспортуються. Продукти гідролізу використовуються клітиною для власних потреб. Перші два етапи ендоцитозу відбуваються без затрат енергії, тоді як наступні потребують енергії АТФ.
Більшість клітин синтезують макромолекули (гормони, білки крові, ферменти) "на експорт". Крім того, у процесі обміну речовин в них утворюються метаболіти, яких треба позбавитися. Виведення цих секретів і екскретів здійснюється за допомогою везикул і називається екзоцитозом.
Розрізняють два види екзоцитозу:
− секреція (виділення із клітини гормонів, білків, ферментів);
− екскреція (виділення із клітини продуктів обміну).

Екзоцитозні пухирці підходять до внутрішньої поверхні клітинної мембрани і контактують з нею за допомогою спеціальних білків. Оболонка пухирця зливається з мембраною і його вміст опиняється у позаклітинному просторі.
Трансмембранний транспорт – це транспорт речовини крізь мембрану через всі її шари.
Трансмембранний транспорт буває двох видів:
· пасивний;
· активний.
Пасивний транспорт – це енергонезалежний вид транспорту, який здійснюється відповідно до градієнтів, що існують в клітині.
Розрізняють такі види пасивного транспорту:
• фільтрацію (транспорт за градієнтом гідростатичного тиску)

• осмос (транспорт за градієнтом осмотичного тиску)

• дифузію (транспорт за градієнтом концентрації, електричних зарядів та ін.)

Основними видами дифузії є полегшена і проста.
Проста дифузія – це дифузія без використання переносників. Вона може здійснюватися через ліпідний бішар і через білки-канали.
Через ліпідний бішар добре дифундують жиророзчинні сполуки (спирти, кисень, вуглекислий газ, азот) і вода. Вода не є жиророзчинною сполукою, але вона добре дифундує через ліпідну плівку, оскільки її молекула має малий розмір і високу кінетичну енергію. Інтенсивність дифузії води через клітинні мембрани дуже велика. Наприклад, через мембрану еритроцита кожну секунду дифундує в обидва боки об’єм води, який у 100 разів перевищує об’єм самого еритроцита. Транспорт води через ліпідний бішар пояснюється «теорією тимчасових пустот». Згідно з нею через постійний рух хвостів фосфоліпідів в мембрані утворюються тимчасові пустоти, через які й проходять молекули води.
Погано дифундують через ліпідний бішар жиронерозчинні сполуки, діаметр яких більший за діаметр молекули води, та іони. При збільшенні розміру молекули дифузійна здатність речовини різко зменшується. Так, діаметр молекули глюкози більший за діаметр молекули води у 3 рази, а швидкість дифузії глюкози менша порівняно з водою у 100 тисяч разів. Іони практично не дифундують через ліпідний бішар, оскільки у водному середовищі мають гідратну оболонку, що суттєво збільшує їх діаметр. Дифузії запобігає й наявність заряду іонів, який взаємодіє з електричним зарядом полярних головок фосфоліпідів.
Для транспорту іонів у мембрані служать білки-канали (інтегральні білки, що вмонтовані у мембрану).
Білки-канали мають такі властивості:
1 Селективність – здатність вибірково пропускати через себе ті чи інші сполуки. Залежно від цієї характеристики білки-канали бувають неселективні (можуть пропускати різні речовини) і селективні (пропускають переважно один тип молекул). Селективність каналу може бути абсолютною, коли через канал проходить один тип молекул, і відносною, коли через канал можуть проходити й деякі інші види молекул. Селективними є натрієві, калієві, кальцієві, хлорні та деякі інші канали.
2 Наявність та стан ворітних механізмів. Ворота каналу – це структури, від стану яких залежить стан каналу (ворота зачинені – канал закритий, ворота відчинені – канал відкритий). Основу відкривання і закривання каналу складають конформаційні зміни білкової молекули. Причиною цих змін можуть бути 2 типи регуляторних впливів (електричний потенціал та хімічні речовини). Відповідно до цього розрізняють 2 типи контролю стану воріт.
1 Потенціалозалежний механізм. Стан ворітного механізму каналу контролюється мембранним електричним потенціалом. Наприклад, коли мембрана нервового волокна має заряд -90 мВ, натрієві і калієві канали закриті, коли ж цей заряд починає зменшуватись, названі канали відкриваються.

Потенціалозалежний механізм контролю стану воріт
Канали, в яких стан воріт залежить від потенціалу на мембрані, називаються потенціалозалежними
2 Лігандозалежний механізм. Стан ворітного механізму каналу контролюється певними хімічними сполуками – лігандами.
При взаємодії каналу з хімічними речовинами змінюється конформація білка, і канал відкривається. Наприклад, при взаємодії ацетилхоліну з натрієвими каналами м’язового волокна ці канали відкриваються.


Лігандозалежний механізм контролю стану воріт
Канали, в яких стан воріт залежить від наявності певних хімічних речовин, називаються лігандозалежними (хемочутливими).
3 Кінетика каналів, яка характеризується швидкістю проходження речовин через канал. Залежно від цієї характеристики канали поділяють на швидкі і повільні.
Полегшена дифузія – це рух речовин за градієнтом їх концентрації за участі білків-переносників. Інтенсивність полегшеної дифузії лімітується кількістю молекул білків-переносників та кінетикою їх зв’язування із речовинами, що переносяться..

Залежність інтенсивності полегшеної дифузії від кількості переносника
Етапи полегшеної дифузії:
· специфічне зв’язування молекули речовини з білком-переносником;.
· конформаційні зміни білка-переносника;
· внаслідок цих змін порушується зв'язок молекули речовини з місцем її зв’язування і вона вільно переходить на інший бік мембрани.

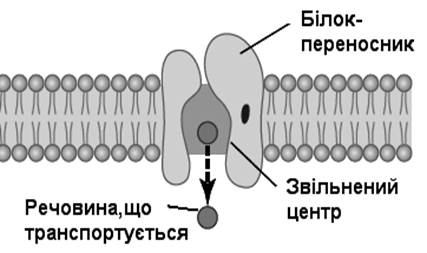
Механізм полегшеної дифузії
Механізмом полегшеної дифузії транспортуються глюкоза і більшість амінокислот.
Фактори, що впливають на інтенсивність дифузії речовин через клітинну мембрану
1 Фактори, пов’язані із мембраною, через яку здійснюється дифузія:
а) проникність мембрани для певної речовини - це швидкість дифузії цієї речовини через одиницю площі мембрани на одиницю різниці концентрації речовини (за відсутності електричного градієнта чи градієнтів тисків).
Проникність мембрани залежить від:
· товщини мембрани (чим більша товщина, тим менша проникність);
· фізико-хімічного стану ліпідного шару мембрани. Цей стан визначається хімічним складом ліпідів мембрани: вмістом насичених і ненасичених жирових кислот. Ненасичені жирові кислоти надають мембрані рідкого стану і збільшують проникність. Фізико-хімічний стан мембрани є дуже чутливим до температури. При гіпотермії мембрани «твердіють» і їх проникність зменшується, а при гіпертермії навпаки.
· кількості білків-каналів та білків-переносників на одиниці площі мембрани та їх функціонального стану (закриті вони чи відкриті);
б) загальна площа мембрани, через яку здійснюється дифузія.
2 Фактори, пов’язані з властивостями і станом речовини, яка дифундує через мембрану:
а) розчинність у ліпідах;
б) температура;
в) наявність електричного заряду;
г) молекулярна маса.
Вплив молекулярної маси на швидкість дифузії неоднозначний. З одного боку, чим більша молекулярна маса речовини, тим більша швидкість руху молекул, тим більша інтенсивність дифузії. З іншого боку, зростання діаметра молекул ускладнює дифузію через білки-канали (якщо діаметр молекули більший за діаметр каналу, дифузія через канал припиняється).
3 Фактори, які є рушійною силою дифузії.
- градієнт концентрацій речовин по обидва боки мембрани;

Інтенсивність дифузії речовини описується рівнянням Фіка

де  - інтенсивність дифузії;
- інтенсивність дифузії;
D – коефіцієнт дифузії;
S – площа поверхні мембрани, через яку здійснюється дифузія;
l - товщина мембрани;
С1-С2 – різниця концентрацій речовини по обидва боки мембрани;
- електричний градієнт;

- градієнт гідростатичних тисків. Транспорт речовин, який здійснюється за градієнтом гідростатичного тиску, називається фільтрацією. Оскільки цей тиск у середині клітини і позаклітинному середовищі майже однаковий, то фільтрація не відіграє істотної ролі у транспорті речовин через клітинну мембрану, але має суттєве значення, коли йдеться про транспорт через судинну стінку;
- градієнт осмотичних тисків. Цей градієнт має велике значення для транспорту розчинників, особливо води. Транспорт за градієнтом осмотичного тиску називається осмосом.
Активний транспорт – це енергозалежний вид транспорту, який здійснюється проти існуючих градієнтів (концентрації, електричного заряду, тисків).
Залежно від джерела енергії, що використовується на здійснення активного транспорту, його поділяють на первинний і вторинний.
Первинний активний транспорт – це механізм активного транспорту, що використовує енергію АТФ або інших макроергічних сполук. Він здійснюється за допомогою білків-насосів.
Кожен білок-насос складається з двох компонентів:
білка-переносника, що зв’язує речовину і переносить її через мембрану;
білка-фермента – АТФ-ази, що здатна вивільнювати енергію АТФ і використовувати її для конформаційних змін білка-переносника.
Прикладами первинного активного транспорту є Na+-K+-насос, Ca2+-насос; Н+-насос. Розглянемо принцип роботи насоса на прикладі Na+-K+-насоса.
Натрій-калієвий насос – білок, що здійснює транспорт Na+ із клітини назовні і транспорт K+ у клітину. Цей механізм працює в усіх клітинах організму.
Na+-K+- насос складається з двох субодиниць: великої (100 000) і малої (55 000). Велика субодиниця має 3 рецепторні місця для зв’язування іонів Na+ на внутрішній поверхні мембрани, 2 рецепторні місця зв’язування іонів К+ на зовнішній поверхні мембрани і АТФ-азу на внутрішній поверхні. Як тільки відбувається зв’язування 3 іонів Na+ і 2 іонів К+ , внутрішня частина набуває АТФ-азної активності. Енергія, яка вивільнюється при розщепленні АТФ, іде на конформаційні зміни білка-переносника, і Na+виноситься з клітини, а К+ йде у клітину.
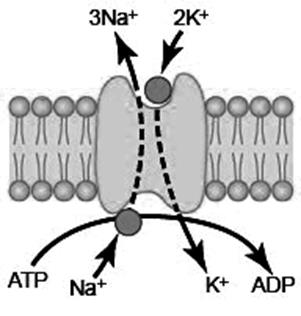
Натрій-калієвий насос
Значення Na+-K+- насоса:
1 Забезпечує різницю концентрацій іонів Na+ і К+ в клітині
і позаклітинному середовищі.
2 Створює електричний потенціал на клітинній мембрані. Електрогенність насоса пов’язана з нееквівалентним перенесенням зарядів під час його роботи (із клітини виносяться 3 позитивні заряди (3 Na+), а вносяться 2 (2 К+)). За один цикл роботи насоса клітина втрачає один позитивний заряд.
3 Дотримання сталості об’єму клітини. Як би цей насос не
працював, то більшість клітин набрякла б.
Вторинний активний транспорт (котранспорт) – це механізм активного транспорту, що безпосередньо використовує для транспорту речовин енергію градієнта концентрації деяких іонів (найчастіше іонів Na+). Цей градієнт, у свою чергу, створюється механізмами первинного активного транспорту, а отже, теж залежить від енергії АТФ.
Вторинний активний транспорт поділяється на два види:
· симпорт (транспорт двох речовин в одному напрямку);
· антипорт (транспорт речовин у протилежних напрямках).
Вторинний активний транспорт здійснюється за допомогою специфічних білків-переносників.
Симпорт. Розглянемо механізм симпорту на прикладі натрієвого котранспорту глюкози. Білок-переносник, який здійснює цей транспорт, має два специфічних місця зв’язування – для Na+ і для глюкози. При приєднанні одного іона Na+ і однієї молекули глюкози білок зазнає конфірмаційних змін, у результаті чого і Na+, і глюкоза опиняються у клітині.
За аналогічним механізмом відбувається і натрієвий котранспорт амінокислот. Існує 5 типів білків-переносників для транспорту амінокислот. Натрієвий котранспорт глюкози і амінокислот особливо інтенсивно відбувається в епітеліальних клітинах кишок і тубулярному епітелії нирок.
Крім названих механізмів котранспорту, у клітинах поширені й інші форми симпорту. Наприклад, Na+-K+-Cl- котранспорт, K+-Cl - котранспорт. У деяких клітинах існує симпорт іонів йоду, заліза, урат-іонів.

Механізм симпорту
Антипорт (іонообмінний механізм). Розглянемо механізм антипорту на прикладі Na+-Са2+-обмінного механізму, який здійснюється майже в усіх клітинах. Білок-переносник, який здійснює цей транспорт, має два специфічних місця зв’язування – на зовнішній поверхні для Na+, на внутрішній - для Са2+. При приєднанні цих іонів білок зазнає конформаційних змін, у результаті яких Na+ опиняється у клітині, а Са2+ - поза клітиною.

Механізм антипорту
За аналогічним механізмом відбувається Na+-Н+-обмінний механізм, який здійснюється в епітеліальних клітинах ниркових канальців, а також Na+-K+, Са2+-Mg2+,Cl--HCO3-, Cl--SO42- - обмінні механізми.
ПОТЕНЦІАЛ СПОКОЮ НЕРВОВИХ І М’ЯЗОВИХ ВОЛОКОН
Між внутрішньою і зовнішньою поверхнями плазматичної мембрани усіх клітин існує різниця електричних потенціалів. Її називають мембранним потенціалом, а в збудливих клітинах – потенціалом спокою.
Мембранний потенціал (МП) – це трансмембранна різниця потенціалів, яка існує між внутрішньою та зовнішньою поверхнями плазматичної мембрани.
Потенціал спокою (ПС) – це мембранний потенціал збудливих клітин, які перебувають у стані спокою. Іншими словами, ПС – це окремий випадок мембранного потенціалу.
Методи реєстрації ПС
Реєстрацію ПС здійснюють за допомогою електродів. Залежно від їх розміщення розрізняють два методи реєстрації ПС.
І Внутрішньоклітинне відведення ПС. Здійснюють за допомогою скляного електрода, діаметр кінчика якого менше 1 мкм. Таким мікроелектродом проколюють клітинну мембрану і вводять його у цитоплазму. У момент проколу мембрани за допомогою пристрою (вольтметра) реєструють різницю потенціалів.


А Б

В
Внутрішньоклітинна реєстрація мембранного потенціалу: А – до, Б – після введення мікроелектрода у клітину; В – запис ПС на осцилографі
ІІ Позаклітинне відведення ПС. У цьому методі обидва електроди розміщені поза клітиною. Названий метод дозволяє реєструвати потенціал пошкодження – різницю потенціалів між інтактною та пошкодженою ділянками тканини. Пошкоджена ділянка є деполяризованою щодо інтактної.


А Б
Позаклітинна реєстрація мембранного потенціалу: А – інтактне нервове волокно; Б – нервове волокно з ушкодженою ділянкою (заштрихована)
Основні фізичні характеристики ПС
1 Полярність. На внутрішній поверхні мембрани потенціал спокою є електронегативним щодо “нуля” Землі. Іншими словами, зовнішня поверхня мембрани заряджена позитивно, а внутрішня – негативно.
2 Сталість величини. Величина ПС для певної структури (нервове волокно, м’язова клітина, нейрон) є сталою.
3 Абсолютне значення. ПС має такі значення: нервові волокна – -90 мВ, скелетні м’язові волокна – -90 мВ, гладенькі м’язи – -50-60 мВ, нейрони центральної нервової системи – -40-60 мВ.
Під впливом деяких факторів абсолютне значення ПС може змінюватися. Розрізняють два види змін величини ПС – деполяризацію і гіперполяризацію..

Зміни абсолютного значення ПС: А – потенціал спокою; Б – деполяризація; В – гіперполяризація
Деполяризація мембрани – це зменшення, а гіперполяризація – збільшення абсолютного значення ПС.
Іонні механізми походження потенціалу спокою
Вперше гіпотезу про іонні механізми походження мембранного потенціалу запропонував у 1896 р. представник української школи фізіологів В.Ю. Чаговець, що очолював кафедру в Київському університеті ім. Св. Володимира.
Сьогодні остаточно доведено, що виникнення мембранного потенціалу пов’язане з дифузією іонів. Для того, щоб зрозуміти суть явища, уявимо собі клітину, у якій цитоплазма заміщена розчином електроліту, який складається з дрібних часток катіонів (наприклад, іонів калію) і крупніших часток аніонів (наприклад, білка). Маленькі частки катіонів можуть легко дифундувати через пори мембрани, в той час як мембрана клітини непроникна для аніонів. Помістимо клітину, заповнену таким електролітом, у середовище, в якому його немає або його концентрація значно менша, ніж у клітині.

Дослід, який пояснює іонні механізми виникнення ПС
У цьому випадку частки катіонів (іонів К+) за законами дифузії будуть виходити з клітини в середовище за градієнтом концентрації, а аніони будуть залишатися у клітині, оскільки мембрана до них непроникна. Перехід катіонів з клітини в позаклітинне середовище призводить до того, що на внутрішній поверхні мембрани створюється надлишок іонів К+ (з’являється знак “+”), а на зовнішній поверхні рівно на стільки ж збільшується кількість аніонів (з’являється знак “–“). Іншими словами, між внутрішньою і зовнішньою поверхнями мембрани виникає різниця потенціалів, тобто мембранний потенціал.

Схема, що пояснює іонні механізми виникнення ПС
Як довго буде продовжуватися дифузія катіонів з клітини у позаклітинне середовище?
Річ у тому, що позитивний заряд, який створюється на зовнішній поверхні мембрани, буде перешкоджати подальшій дифузії іонів К+ за градієнтом концентрації. Калій почне переходити у клітину за електричним градієнтом
(мембрана зсередини заряджена негативно, а калій заряджений позитивно). Врешті-решт, при певному мембранному потенціалі настає стан рівноваги. Це означає, що кількість іонів К+, яка виходить з клітини за градієнтом концентрації, дорівнює кількості іонів К+, яка входить у клітину за електричним градієнтом. Величина мембранного потенціалу, при якій настає такий стан рівноваги, отримала назву рівновагового потенціалу для даного іона.
Таким чином, потенціал рівноваги – це рівень електричного потенціалу мембрани, при якому дифузія іона за градієнтом концентрації урівноважується протилежно спрямованою дифузією даного іону за електричним градієнтом. Або, іншими словами, це рівень електричного потенціалу на мембрані, який повністю припиняє дифузійний потік іона за градієнтом концентрації.
Величина рівновагового потенціалу розраховується за формулою Нернста, яка після низки перетворень набуває такого вигляду:
 де Е – рівноваговий потенціал (потенціал Нернста);
де Е – рівноваговий потенціал (потенціал Нернста);
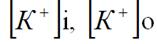 – концентрації іонів калію відповідно всередині і зовні клітини.
– концентрації іонів калію відповідно всередині і зовні клітини.
Підставивши у формулу Нернста значення концентрації іонів К+ всередині клітини (140 мекв/л) і в позаклітинному середовищі (4 мекв/л), отримаємо значення калієвого рівновагового потенціалу, яке дорівнює – 94 мВ.
Якщо у клітині не один, а декілька типів іонів (наприклад, калію, натрію, хлору), які проникають через мембрану, то величина мембранного потенціалу розраховується за формулою Гольдмана-Ходжкіна-Катца:

де Р – проникність мембрани для даного іона.
Потенціал спокою нервових і скелетних волокон
Внутрішньоклітинне відведення мембранного потенціалу великих нервових і скелетних м’язових волокон свідчить про те, що потенціал спокою у цих структурах дорівнює –90 мВ. Таке значення потенціалу спокою пояснюється існуванням основних і додаткових чинників, які впливають на мембранний потенціал у цих структурах.
Основні чинники:
1 Різниця концентрацій іонів К+ у цитоплазмі і в позаклітинній рідині. Так, у цитоплазмі нервового волокна вміст іонів К+ у 35 разів вищий, ніж у позаклітинному середовищі.
2 Висока проникність мембрани до іонів К+, низька проникність до іонів Na+ і непроникність до внутрішньоклітинних білків - аніонів.
Саме іони К+ та особливості проникності клітинної мембрани визначають значення потенціалу спокою. Про це свідчить той факт, що потенціал спокою нервових і скелетних м’язових волокон (-90 мВ) дуже близький за значенням до калієвого рівновагового потенціалу (-94 мВ).
Додаткові чинники:
1 Пасивний вхід іонів Na+ у клітину. Хоча у стані спокою проникність мембрани для іонів Na+ в багато разів менша, ніж для іонів К+ (приблизно у 100 разів), постійно існує дифузія іонів Na+ в клітину. Вона обумовлена, з одного боку, дуже великим електрохімічним градієнтом для іонів Na+, спрямованим у клітину (концентрація іонів Na+ поза клітиною в 10 разів вища, ніж всередині, крім того, іони Na+ намагаються увійти у клітину, всередині якої знак “– “), а з іншого боку, – наявністю у мембрані клітин білків, здатних пропускати через себе іони Na+, коли клітина перебуває у стані спокою. Такі білки отримали назву “калій-натрієві канали витікання”. Вони є неселективними іонними каналами, через які дифундують іони через мембрану,що перебуває у стані спокою. Ці білки значно легше пропускають через себе іони К+, ніж Na+ (приблизно у 100 разів).
Постійний пасивний вхід Na+ у клітину зменшує її мембранний потенціал, тому його величина насправді менша від калієвого рівновагового потенціалу.
Розрахунки за формулою Гольдмана-Ходжкіна-Катца показують, що при існуючому пасивному вході Na+ у клітину потенціал спокою повинен був би дорівнювати
–86 мВ. А насправді він дорівнює –90 мВ. Чому? Це пояснює наступний додатковий чинник, що впливає на ПС.
2 Робота Na+, K+-насосу.
Na+, K+-насос – це білки клітинної мембрани, які здійснюють активний транспорт іонів Na+ та K+ проти градієнтів їх концентрацій. Робота цього насоса має два наслідки:
· підтримується градієнт концентрації іонів Na+ і K+ по обидва боки мембрани, незважаючи на пасивний вхід Na+ і вихід K+ з клітини;
· здійснюється безпосередній вплив на величину ПС завдяки електрогенності насоса. За один цикл роботи насоса відбувається нееквівалентний обмін іонів Na+ і К+ (із клітини видаляється 3 іони Na+, а надходить тільки 2 іони K+), що призводить до незначної гіперполяризації мембрани, внаслідок чого потенціал спокою нервових і скелетних м’язових волокон дорівнює –90 мВ, а не –86 мВ, як слід було б очікувати з проведених розрахунків за формулою Гольдмана-Ходжкіна-Катца.
Фізіологічне значення потенціалу спокою
Наявність ПС на мембрані клітин визначає таку їх рису, як збудливість, тобто здатність збуджуватись у відповідь на дію подразника.
З точки зору електрофізіології це означає, що наявність ПС є необхідною умовою для виникнення потенціалу дії (ПД).
Зміни ПС в умовах патології
В умовах патології зміни ПС збудливих клітин найбільш часто обумовлені такими порушеннями: Зміни позаклітинної концентрації іонів К+.
Можливі два варіанти порушень:
· гіперкаліємія. При цьому іони К+ входять у клітину і розвивається деполяризація мембрани;
· гіпокаліємія. У цьому випадку, навпаки, іони К+ виходять з клітини, що призводить до гіперполяризації мембрани.
Зміни внутрішньоклітинної концентрації іонів К:
· при посиленому розпаді білків (збільшення швидкості катаболізму). У даному випадку в результаті зменшення концентрації внутрішньоклітинних білків зменшується внутрішньоклітинна концентрація іонів К+, що призводить до деполяризації мембрани;
· посиленому синтезі білків (збільшенні швидкості анаболізму). При цьому, навпаки, збільшення вмісту білків всередині клітини супроводжується збільшенням внутрішньоклітинної концентрації іонів К+. Останнє призводить до гіперполяризації мембрани.
Збільшення проникності клітинної мембрани до іонів Na +.
· при пошкодженні клітинної мембрани (порушення її бар’єрної функції);
· при появі (адсорбції) нових білків або інших сполук, що пропускають через себе іони Na+ (наприклад, адсорбція комплексів антиген + антитіло, антибіотиків – іонофорів).
Порушення роботи Na+- K+-насосів.
Найпоширенішою причиною таких порушень є дефіцит АТФ. При розладах функції Na+- K+-насосів відбувається зменшення ПС, обумовлене пасивним входом Na+ у клітину.
Незалежно від причин зміни ПС в умовах патології (деполяризація або гіперполяризація) призводить до стійкого зменшення збудливості клітин, що виявляється широким спектром порушень з боку нервової системи, серця, скелетних м’язів і органів, до складу яких входить гладенька мускулатура.
ПОТЕНЦІАЛ ДІЇ НЕРВОВИХ І М'ЯЗОВИХ ВОЛОКОН
Потенціал дії (ПД) – це швидка зміна мембранного потенціалу, яка виникає в збудливих структурах у відповідь на дію подразника.
Власне здатність генерувати ПД є головною рисою, яка відрізняє збудливі структури (нервові, м’язові і деякі типи секреторних клітин) від інших.
Структура ПД
При внутрішньоклітинному відведенні ПД великого нервового волокна має форму, наведену на рисунку.

Потенціал дії при внутрішньоклітинному відведенні: І – фаза спокою; ІІ – фаза деполяризації; ІІІ – фаза реполяризації; ІV – фаза слідових потенціалів.
Виділяють такі фази ПД:
1 Фаза спокою.
Вона представлена потенціалом спокою. Без потенціалу спокою неможливий розвиток ПД.
2 Фаза деполяризації (висхідна фаза).
Це дуже швидка (0,1 мс) зміна мембранного потенціалу від –90 мВ до + 35 мВ. У великих нервових волокнах позитивні значення ПД отримали назву овершута. У малих нервових волокнах і нейронах овершута немає.
3 Фаза реполяризації (низхідна фаза).
Це фаза відновлення негативного заряду на внутрішній поверхні мембрани. Її тривалість значно перевищує тривалість фази деполяризації.
4 Фаза слідових потенціалів.
Після завершення ПД мембранний потенціал ще деякий час відхиляється від рівня ПС. Розрізняють слідову деполяризацію та слідову гіперполяризацію. Амплітуда слідових потенціалів ніколи не перевищує 15-20% ПД.
Основні фізичні характеристики ПД
1 Полярність ПД.
На внутрішній поверхні мембрани ПД є електропозитивним, а на зовнішній – електронегативним стосовно “нуля” Землі. Іншими словами, під час розвитку ПД відбувається реверсія потенціалу - зміна полярності заряду на внутрішній і зовнішній поверхнях мембрани.

Реверсія мембранного потенціалу під час ПД.
2 Значення мембранного потенціалу на вершині ПД (величина овершута).
У великих нервових і скелетних м’язових волокнах ця величина становить від +30 до +40 мВ.
3 Амплітуда ПД.
Це відстань від рівня потенціалу спокою до найвищої точки овершута. У великих нервових і скелетних м’язових волокнах цей показник дорівнює 110 - 130 мВ.
4 Тривалість ПД.
Ця характеристика ПД суттєво відрізняється у різних типах збудливих структур. Так, у великих нервових і скелетних м’язових волокнах цей показник дорівнює 0,5 – 5 мс, у той час як у волокнах серцевого м’яза він досягає 300 мс.
5 Довжина хвилі ПД.
ПД здатний поширюватися по нервових і м’язових волокнах, при цьому у різних структурах довжина його хвилі становить від 0,1 до 5 см.
6 Швидкість поширення ПД.
Залежно від типу волокон цей показник становить 0,5 - 120 м/с.
Основні фізіологічні характеристики ПД
1 Підкоряється закону “все або нічого”. Це означає що:
- ПД виникає при дії подразника, сила якого не менша за певну порогову величину;
- Фізичні характеристики ПД (амплітуда, тривалість, форма) не залежать від сили подразника.
2 Здатність до самопоширення вздовж мембрани клітини без затухання (бездекрементно), тобто без зміни своїх фізичних характеристик.
3 ПД супроводжується рефрактерністю.
4 ПД не здатний до сумації, тобто до накладання.
Іонні механізми розвитку ПД
Виникнення ПД пов’язане з існуванням у плазматичній мембрані клітин двох видів білків – каналів. Зупинимося коротко на їх характеристиці.
І Потенціалозалежні натрієві білки-канали.
Ці канали мають дві властивості: селективність і електрозбудливість.
Селективність – це здатність каналу пропускати через себе тільки іони Na+, тому такі канали називаються натрієвими.
Електрозбудливість – це здатність каналу відкриватися і закриватися у відповідь на зміни мембранного потенціалу (звідки назва – потенціалозалежні).
Na+ канал складається з двох частин:
- Власне транспортної системи – білка, який пропускає через себе іони Na+.
- Воріт – частини каналу, яка визначає відкритий і закритий його стани.
Потенціалозалежний натрієвий канал має двоє воріт:
- активаційні (швидкі). Вони знаходяться на зовнішній поверхні білка-каналу, мають здатність швидко відкриватися і закриватися;
- інактиваційні (повільні). Вони знаходяться на внутрішній поверхні білка-каналу і характеризуються тим, що повільно відкриваються і закриваються.
Розрізняють три функціональні стани потенціалозалежних натрієвих каналів
- Стан спокою. Активаційні ворота закриті, інактиваційні – відкриті. Канал непроникливий для іонів Na+. У такому стані канал перебуває тоді, коли мембранний потенціал дорівнює –90 мВ (рівень потенціалу спокою).
- Активований стан. Обоє воріт (активаційні та інактиваційні) відкриті, внаслідок чого канал проникливий для іонів Na+. Ці іони проходять ззовні у клітину по градієнту концентрації за механізмом простої дифузії. Причиною відкриття активаційних воріт є зміни мембранного потенціалу від –90 мВ до +35 мВ (деполяризація).
- Інактивований стан. Активаційні ворота відкриті, інактиваційні – закриті. Канал непроникний для іонів Na+. Такий стан настає внаслідок змін мембранного потенціалу від –90 мВ до +35 мВ. Конформаційні зміни білка-каналу, що виникають при деполяризації, призводять не тільки до швидкого відкриття активаційних воріт, але й до закриття інактиваційних. Однак останнє відбувається значно повільніше.

Потенціалозалежні натрієві канали.
ІІ Потенціалозалежні калієві канали.
Вони мають такі самі властивості, як і натрієві канали, – селективність та електрозбудливість.
К +- канал складається з двох частин:
1) власне транспортної системи – білка, який пропускає через себе іони К+;
2) воріт. На відміну від натрієвих каналів, у калієвому каналі одні ворота, які розміщені з внутрішнього боку мембрани.
Розрізняють два функціональних стани калієвих каналів:
- стан спокою. Ворота закриті. Канал непроникний для іонів К+. У такому стані канал перебуває тоді, коли мембранний потенціал дорівнює –90 мВ.
- активований стан. Ворота відкриті. Канал проникний для іонів К+. Такий стан настає при зміні мембранного потенціалу від –90 до +35 мВ внаслідок конфірмаційних змін білка-каналу. Оскільки ці зміни відбуваються повільно, то й ворота відкриваються повільно.

Потенціалозалежні калієві канали
Таким чином, можна виділити дві основні відмінності калієвих каналів:
- калієві канали не інактивуються, оскільки не мають інактиваційних воріт;
- відкриття і закриття калієвих каналів відбувається повільно.
З урахуванням структури і функціональних особливостей іонних каналів розглянемо походження основних фаз ПД: деполяризації і реполяризації.
Фаза деполяризації
Основний механізм її виникнення – раптове у 500 - 5000 разів збільшення проникності клітинної мембрани для іонів Na+, внаслідок чого названі іони входять у клітину за електрохімічним градієнтом (вхідний натрієвий струм), викликаючи швидку деполяризацію. Молекулярну основу такого різкого збільшення проникності мембрани становить перехід потенціалозалежних натрієвих каналів в активований стан. Причиною цього є відкриття активаційних (швидких) воріт каналу, обумовлене деполяризацією мембрани до критичного рівня, який дорівнює -70 -50 мВ. Подібна деполяризація мембрани до критичного рівня відбувається внаслідок дії на клітину подразників, здатних викликати збудження. Схематично механізм розвитку фази деполяризації ПД зображено на рисунку.

Механізм розвитку фази деполяризації ПД.
В основі швидкої деполяризації лежить принцип позитивного зворотного зв’язку, який має важливе значення в ініціюванні фізіологічних процесів. Так, деполяризація мембрани викликає активацію натрієвих каналів, внаслідок чого збільшується вхід іонів Na+ в клітину. Це, у свою чергу, збільшує деполяризацію мембрани, внаслідок чого збільшується кількість активованих натрієвих каналів і т.д.
До якого значення потенціалу буде відбуватися деполяризація? Теоретично можливим є значення, яке дорівнює значенню натрієвого рівновагового потенціалу. Розрахунки за формулою Нернста свідчать, що це +70 мВ. Насправді ж деполяризація досягає тільки рівня +35 мВ. Чому? Це пояснюється подіями, які обумовлюють розвиток наступної фази ПД.
Фаза реполяризації
В її розвитку мають значення дві події:
1 Інактивація потенціалозалежних натрієвих каналів.
Через 0,1 мс від початку розвитку ПД починають закриватися інактиваційні (повільні) ворота натрієвих каналів, внаслідок чого проникність мембрани до Na+ різко зменшується. Причиною закриття інактиваційних воріт (як і відкриття активаційних) є деполяризація мембрани. Але на відмінну від швидких активаційних воріт інактиваційні закриваються повільно, тому їх повне закриття настає тільки через 0,1 мс.
Інактивація натрієвих каналів пояснює той факт, що деполяризація мембрани під час ПД не доходить до рівня рівновагового натрієвого потенціалу.
2 Активація потенціалозалежних калієвих каналів.
Одночасно з початком інактивації натрієвих каналів, тобто через 0,1 мс, починають відкриватися ворота потенціалозалежних калієвих каналів, внаслідок чого збільшується проникність мембрани до іонів К+. Причиною відкриття воріт калієвих каналів є конфірмаційні зміни білка-каналу, обумовлені деполяризацією. Оскільки ці зміни виникають повільно, то відкриття калієвих каналів затримується на 0,1 мс.
Внаслідок відкриття калієвих каналів іони К+ виходять із клітини за електрохімічним градієнтом (вихідний калієвий струм) – у результаті відбувається поступове відновлення мембранного потенціалу, тобто реполяризація.
Як тільки мембранний потенціал досягає рівня потенціалу спокою (-90 мВ), відбуваються такі зміни у каналах:
- в натрієвих каналах активаційні ворота швидко закриваються, а інактиваційні – повільно відкриваються. Канал переходить у стан спокою;
- в калієвих каналах ворота повільно закриваються і реполяризація припиняється. Однак оскільки закриття калієвих каналів повільне, то вихід К+ з клітини продовжується ще деякий час і після досягнення рівня потенціалу спокою. Цим, зокрема, пояснюється виникнення слідової гіперполяризації, коли мембранний потенціал може наближатися до значення калієвого рівновагового потенціалу (-94 мВ).
Фізіологічне значення ПД
Серії ПД (імпульси), які поширюються вздовж клітинної мембрани, являють собою “сигнали”, які забезпечують передачу інформації по нервових і м’язових волокнах.
Методи реєстрації ПД
І Внутрішньоклітинне відведення ПД.
Мікроелектрод вводять у клітину і реєструють класичну форму ПД, яка представлена на рис. 4.1.
ІІ Позаклітинне відведення ПД.
Здійснюють за допомогою електродів, розміщених поза клітиною. Існує два методи позаклітинної реєстрації ПД:
1 Біполярне відведення – реєстрація двофазного ПД. Дозволяє реєструвати ПД, який поширюється вздовж непошкодженого нервового волокна.




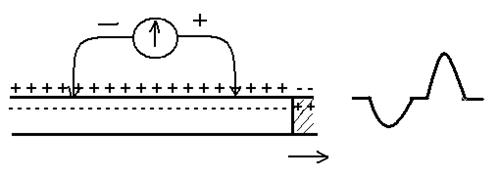
Реєстрація двофазного ПД за допомогою позаклітинних електродів. Заштриховано ділянки деполяризації волокна. Стрілкою вказано напрямок поширення ПД.
2 Уніполярне відведення – реєстрація однофазного ПД. Дозволяє реєструвати ПД при порушеннях його проведення.

Реєстрація однофазного ПД за допомогою позаклітинних електродів. Чорним показано пошкоджену ділянку волокна, через яку ПД не проводиться. Стрілкою вказано напрямок поширення ПД.
Причини і умови виникнення ПД
ПД виникає внаслідок взаємодії подразника зі збудливою клітиною. У цій взаємодії подразник є власне причиною ПД, а властивості клітини визначають умови його виникнення.
За походженням подразники, що здатні викликати ПД, можна поділити на 2 групи:
1 Фізичні подразники:
- електричний струм;
- механічні фактори (тиск, вібрація, розтягнення).
2 Хімічні подразники:
- нейромедіатори;
- хімічні сполуки, специфічні для певних видів хеморецепторів (вуглекислий газ, іони водню).
Загальною рисою всіх подразників, здатних викликати ПД, є те, що всі вони призводять до розвитку деполяризації клітинної мембрани.
Основною властивістю клітини, яка визначає умови виникнення ПД, є її збудливість.
ЗБУДЛИВІСТЬ
Збудливість – це здатність клітини відповідати збудженням, тобто генерацією ПД, на дію подразника.
Параметри, що визначають збудливість клітини:
1 Величина ПС. Вона безпосередньо впливає на кількість інактивованих натрієвих каналів. Якщо ПС стає більш позитивним, то зростає кількість інактивованих натрієвих каналів. При досягненні ПС рівня –50 мВ у клітинах савців усі 100% натрієвих каналів інактивуються, і жоден подразник будь-якої сили не здатний викликати ПД. Оскільки величина ПС визначається концентрацією іонів К+, то саме цим іонам належить провідна роль, якщо мова йде про названий вище параметр збудливості.
2 Критичний рівень деполяризації. Це величина мембранного потенціалу, при досягненні якої виникає ПД. Не кожна деполяризація мембрани викликає ПД, а тільки та, яка досягає критичної величини. У великих нервових волокнах вона у середньому становить –65 мВ.

Показники збудливості клітини: Екр – критичний рівень деполяризації; Епс – рівень потенціалу спокою; ∆V - пороговий потенціал (поріг деполяризації).
Різниця між критичним рівнем деполяризації (Екр) і ПС (Епс) називається пороговим потенціалом, або порогом деполяризації (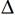 V).
V).

У даному випадку  V = -65 – (-90) = 25 мВ.
V = -65 – (-90) = 25 мВ.
Основним фактором, що визначає критичний рівень деполяризації, є позаклітинна концентрація іонів Са2+.
При збільшенні цієї концентрації Екр є більш позитивним, і відповідно зростає поріг деполяризації ( V). Зменшення позаклітинної концентрації Са2+ викликає протилежний ефект – Екр наближається до рівня ПС, а відповідно
V). Зменшення позаклітинної концентрації Са2+ викликає протилежний ефект – Екр наближається до рівня ПС, а відповідно  V зменшується.
V зменшується.
Виходячи зі значення розглянутих параметрів, можна виділити чотири зміни збудливості.



Варіанти змін збудливості клітини.
Зміни збудливості під час збудження
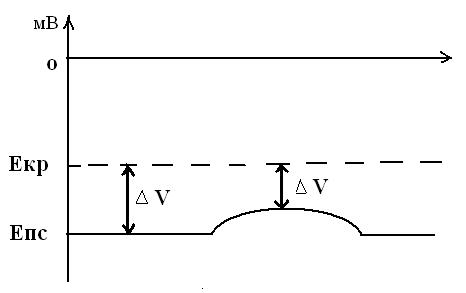
Під час і відразу після збудження збудливість клітини змінюється таким чином, що виділяються два періоди: період абсолютної і період відносної рефрактерності.
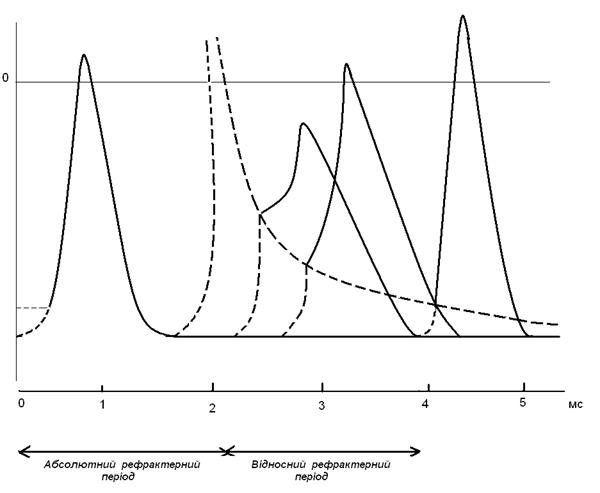
Періоди абсолютної і відносної рефрактерностей.
1 Період абсолютної рефрактерності. Тривалість цього періоду для великих нервових волокон – від початку ПД і ще деякий час після його завершення, приблизно 2 мс. У цей період клітина незбудлива – жоден подразник не здатний викликати ПД.
Існування абсолютної рефрактерності пояснюється тим, що в цей період усі натрієві канали перебувають в інактивованому стані. Для того щоб збудливість відновилася, необхідний перехід натрієвих каналів з інактивованого стану у стан спокою. Це досягається закриттям активаційних і відкриттям інактиваційних воріт білків-каналів. Оскільки перші закриваються швидко, а другі відкриваються повільно, то навіть при досягненні мембранним потенціалом рівня –90 мВ збудливість ще деякий час не відновлюється. Тому тривалість періоду абсолютної рефрактерності більше тривалості ПД. Тривалість періоду абсолютної рефрактерності визначає максимально можливу кількість ПД, яка може виникати у нервовому волокні за 1 с. Якщо в безмієлінових нервових волокнах тривалість цього періоду дорівнює 2 мс, то 1: 0, 002 = 500 імп./с. У мієлінізованих волокнах, де тривалість абсолютної рефрактерності становить 0,4 мс, 1: 0,0004 = = 2500 імп./с.
Вперше увагу на різну здатність збудливих структур відтворювати різну кількість подразнень звернув Н.Е Введенський (1901). Так, частота розряду рухових нервових волокон при довільних рухах, як правило, не перевищує 50 за 1 секунду. Тоді як у чутливих нервових волокнах (наприклад, у слуховому або зоровому нерві) при сильному подразненні вона може досягати 1000 за 1 секунду і більше. Максимальну кількість потенціалів дії («максимальний ритм»), яку здатна збудлива структура генерувати за 1 секунду у відповідності з ритмом подразнення, Н.Е.Введенський запропонував як показника лабільності тканини. Сьогодні зрозуміло, що максимальний ритм імпульсації нервових і м’язових волокон визначається швидкістю процесів зміни іонної провідності, які лежать в основі абсолютної і відносної рефрактерностей.
2 Період відносної рефрактерності. Виникає відразу ж за періодом абсолютної рефрактерності і становить 1/2 -1/4 від його тривалості. Для нього характерні дві риси:
- збільшення порога деполяризації. Це означає, що
у зазначений період ПД може виникати, але під впливом подразників більшої сили, ніж звичайно;
- ПД, який виникає в цей період, характеризується змінами форми – зменшуються амплітуда та крутизна наростання, збільшується тривалість.
Можливість виникнення ПД в період відносної рефрактерності пояснюється тим, що в цей час певна кількість натрієвих каналів уже відновила свій початковий стан (стан спокою) однак, значна їх кількість перебуває ще в інактивованому стані. Крім того, калієві канали ще повністю не закриті, тому калієвий вихідний струм перешкоджає виникненню ПД, який з’являється у відповідь на дію сильного подразника в період відносної рефрактерності.
Роль різних іонів у розвитку електрофізіологічних явищ у клітинах
Як випливає з вищесказаного, провідна роль у розвитку мембранних потенціалів у збудливих клітинах належить трьом іонам: К+, Na+, Ca2+. Підіб'ємо підсумки уже зазначеному:
1 Іони К+. Вони визначають рівень ПС. Мають також значення у розвитку ПД, обумовлюючи фазу реполяризації.
2 Іони Na+. Є головними іонами, що визначають розвиток ПД (фаза деполяризації). У той же час впливають на остаточну величину ПС (пасивний вхід Na+ у клітину).
3 Іони Са2+. Визначають величину критичного рівня деполяризації.
Зміни збудливості в умовах патології і дії фармакологічних агентів
Розглянемо деякі основні причини порушення збудливості:
І Порушення іонного складу позаклітинної рідини
1 Зміни концентрації іонів К+:
- гіперкаліємія. Викликає деполяризацію клітинних мембран (вхід К+ у клітину). Залежно від концентрації К+ можливі такі порушення збудливості. Якщо позаклітинний вміст К+ зростає від 4 до 8 мекв/л, тоді внаслідок незначної деполяризації мембрани пороговий потенціал зменшується, і збудливість зростає. Якщо концентрація К+ у позаклітинній рідині стає вищою за 8 мекв/л, тоді внаслідок збільшення кількості інактивованих натрієвих каналів збудливість зменшується (період відносної рефрактерності). Якщо концентрація К+ досягає 35 мекв/л і більше, то в результаті значної деполяризації мембрани всі натрієві канали переходять в інактивований стан. Клітина повністю втрачає збудливість (період абсолютної рефрактерності);
- гіпокаліємія. Викликає гіперполяризацію мембрани (вихід К+ з клітини), внаслідок чого пороговий потенціал збільшується і збудливість зменшується.
2 Зміни концентрації Na+:
- гіпонатріємія. В умовах in vivo цей стан призводить до збільшення збудливості через осмотичні механізми. Суть їх полягає у такому: зменшення позаклітинної концентрації Na+ ® зменшення осмотичного тиску в позаклітинному середовищі (Росм) ® перехід води у клітини (клітинний набряк) ® зменшення внутрішньоклітинної концентрації К+ (ефект розведення) ® зменшення ПС ® зменшення порогового потенціалу ® збільшення збудливості. В умовах in vitro, якщо замінити Na+ в середовищі на інші іони для збереження Росм, ПД не виникає, оскільки не розвивається фаза деполяризації;
- гіпернатріємія. Впливає на збудливість через осмотичні механізми. При цьому розвиваються явища, аналогічні до гіпонатріємії, тільки у протилежному напрямку (див. вище). У результаті пороговий потенціал збільшується, збудливість знижується.
3 Зміни концентрації іонів Са2+:
a. гіпокальціємія. Викликає наближення критичного рівня деполяризації (Екр) до рівня ПС. При цьому пороговий потенціал зменшується, а збудливість зростає. Якщо Екр буде дорівнювати ПС, то ПД у нервових волокнах виникають спонтанно, тобто без дії подразників, – розвивається синдром тетанії (спонтанні скорочення м’язів – судоми);
b. гіперкальціємія. Викликає віддалення Екр від рівня ПС, приводить до збільшення порогового потенціалу і зменшення збудливості.
ІІ Ушкодження клітини
Завжди супроводжується стійкою деполяризацією мембрани (втратою ПС). В основі цього лежать такі механізми:
- збіл
Date: 2016-11-17; view: 1038; Нарушение авторских прав