
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химические свойства спиртов и альдегидов
|
|
Альдегиды:Наличие в карбонильной группе -связи и поляризации обуславливает характерные свойства альдегидов и кетонов (см. §6.3.-6.5.). За счет поляризации связи С=О присоединение полярных частиц типа Н-Х происходит более легко по сравнению с двойной углерод -углеродной связью.
Наиболее существенные отличия в химических свойствах альдегидов от свойств соответствующих кетонов связаны с повышенной активностью -водородного атома, которая вызывается поляризацией связи С-Н под электроноакцепторным влиянием карбонильной группы. По этой причине альдегиды хорошо окисляются, тогда как кетоны менее подвержены действию окислителей.
Спирты:
1) Горение: Как и большинство органических веществ спирты горят с образованием углекислого газа и воды:
C2H5-OH + 3O2 -->2CO2 + 3H2O
При их горении выделяется много теплоты, которую часто используют в лабораториях (лабораторные горелки). Низшие спирты горят почти бесцветным пламенем, а у высших спиртов пламя имеет желтоватый цвет из-за неполного сгорания углерода.
2) Реакция со щелочными металлами
C2H5-OH + 2Na --> 2C2H5-ONa + H2
При этой реакции выделяется водород и образуется алкоголят натрия. Алкоголяты похожи на соли очень слабой кислоты, а также они легко гидролизуются. Алкоголяты крайне неустойчивы и при действии воды - разлагаются на спирт и щелочь. Отсюда следует вывод, что одноатомные спирты не реагируют со щелочами!
3) Реакция с галогеноводородом
C2H5-OH + HBr --> CH3-CH2-Br + H2O
В этой реакции образуется галогеноалкан (бромэтан и вода). Такая химическая реакция спиртов обусловлена не только атомом водорода в гидроксильной группе, но и всей гидроксильной группой! Но эта реакция обратима: для её протекания нужно использовать водоотнимающее средство, например серную кислоту.
4) Внутримолекулярная дегидратация (в присутствии катализатора H2SO4)
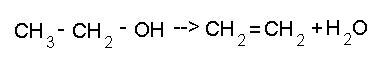
В этой реакции при действии концентрированной серной кислоты и при нагревании происходит дегидратация спиртов. В процессе реакции образуется непредельный углеводород и вода. Отщепление атома водорода от спирта может происходить в его же молекуле (то есть происходит перераспределение атомов в молекуле). Эта реакция является межмолекулярной реакцией дегидратации. Например, так:
 В процессе реакции происходит образование простого эфира и воды.
В процессе реакции происходит образование простого эфира и воды.
5) реакция с карбоновыми кислотами:

Если добавить к спирту карбоновую кислоту, например уксусную, то произойдёт образование простого эфира. Но сложные эфиры менее устойчивы, чем простые эфиры. Если реакция образования простого эфира почти необратима, то образование сложного эфира - обратимый процесс. Сложные эфиры легко подвергаются гидролизу, распадаясь на спирт и карбоновую кислоту.
6) Окисление спиртов.
Кислородом воздуха при обычной температуре спирты не окисляются, но при нагревании в присутствии катализаторов идёт окисление. Примером может служить оксид меди (CuO), марганцовка (KMnO4), хромовая смесь. При действии окислителей получаются различные продукты и зависят от строения исходного спирта. Так, первичные спирты превращаются в альдегиды (реакция А), вторичные - в кетоны (реакция Б), а третичные спирты устойчивы к действию окислителей.
- a) для первичных спиртов

- б) для вторичных спиртов
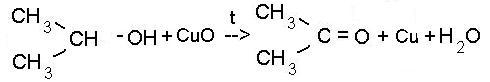
- в) третичные спирты оксидом меди не окисляются!
Date: 2016-06-06; view: 2819; Нарушение авторских прав