
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Окончание таблицы 33.2
|
|
| Цефалотин | Вас. subtilis ATCC 6633 | № 11 | № 7 + 0,1 % глюкозы | 40 млн спор на 1 мл среды | Цефало- тина на- триевая соль | Буфер № 1 | Буфер № 1 | 0,5 мкг/мл | |||
| Хлортетрациклин | Вас. subtilis, var. Л2 | № 6 + 1 % глюкозы | 30 млн спор на 1 мл среды | Хлортет- рациклина гидрохло- рид | 0,01 н. ра- створ хло- ристоводо- родной кислоты | Буфер № 2 | 1 мкг/мл | ||||
| Эритромицин | Вас. cereus, var. mycoides HB | №9 | 20 млн спор на 1 мл среды | Эритроми- цин | 1 мл этило- вого спирта на 10 мг на- вески, затем буфер № 4 до 1000 ЕД/мл | Буфер № 4 | 2 мкг/мл |
1 Условия определения антимикробной активности антибиотиков указанных наименований распространяются и на их лекарственные формы.
2 АТСС – Американская коллекция типовых культур, NCTC – Национальная коллекция типовых культур.
3 Состав, приготовление сред и буферных смесей см. табл. 33.3 и 33.4.
4 Глюкозу добавляют в расплавленный агар в виде 40 % стерильного раствора.
5 Объемы сред указаны для чашек размером 20×100 мм. При использовании лунок количество среды для нижнего или одного слоя удваивается.
6 Допускается уменьшение или увеличение посевной дозы тест-микроба в зависимости от плотности получаемого газона и четкости очертания зон.
7 В таблице указана контрольная концентрация раствора стандартного образца для метода с использованием стандартной кривой.
8 Допускается при необходимости уменьшение или увеличение контрольной концентрации раствора стандартного образца.
9 Для полного растворения препарата раствор помещают в холодильник при температуре от 4 до 10 °С.
10 Активность канамицина В определяется после гидролиза по стандартному образцу канамицина А.
11 Срок годности рабочих растворов в буфере при комнатной температуре – не более 30 мин.
12 Срок годности основного раствора стандартного образца микогептина при комнатной температуре – не более 4-5 ч.
13 Основной раствор готовят в концентрации 1 мг в 5 мл 0,1М раствора натрия гидроксида (0,1 моль/л).
После инкубации в термостате измеряют диаметры зон угнетения роста тест-микробов. Далее вычисляют среднюю величину диаметров зон для раствора кон- трольной концентрации стандартного образца в каждой группе из трех чашек, затем среднюю величину диаметров зон для раствора контрольной концентрации стандартного образца из всех 12 чашек (общую среднюю из 36 зон). По разности между средней величиной зоны контрольной концентрации, установленной из 12 чашек, и средней величиной зоны контрольной концентрации, установленной из 3 чашек с каждой отдельной концентрацией, находят поправку к величине зоны данной концентрации. Найденную поправку прибавляют к средней величине диаметра зоны данной концентрации, если она положительная, и вычитают, если она отрицательная.
П р и м е р. Общая средняя величина зоны для раствора контрольной концентрации стандартного образца 1 мкг/мл, рассчитанная из 36 зон, равна 19,2 мм. Средняя величина зоны для раствора той же концентрации, установленная из 3 чашек, на которых испытывался раствор с концентрацией 0,83 мкг/мл стандартного образца, равна 19 мм. Следовательно, величина поправки будет +0,2 мм. Средняя величина зоны для концентрации 0,83 мкг/мл равна 17,9 мм; прибавляя поправку +0,2 мм, получаем величину 18,1 мм. Таким образом, исправляют значение величины зон для растворов всех
концентраций стандартного образца и получают величины d1, d2, d4, d5.
Для исследования активности испытуемого образца проводят несколько опре-
делений, используя для каждого по 3 чашки, в которые закапывают раствор контрольной концентрации стандартного образца и раствор испытуемого образца с концентрацией, близкой к контрольной. Внесение растворов контрольной концентрации стандартного и испытуемого образцов в каждой группе из трех чашек должно проводиться одномоментно. После инкубации измеряют зоны угнетения роста тест-микроба, образуемые растворами контрольной концентрации стандартного и испытуемого образцов. Находят среднее значение величин зон из
3 чашек.
Расчет антимикробной активности испытуемых образцов по стандартной кривой может быть проведен двумя способами: графическим методом или путем непосредственного расчета с использованием соответствующих формул.
Расчет активности испытуемого образца графическим методом. По исправленным значениям диаметров зон d1, d2, d4, d5 для всех концентраций растворов стандартного образца С1, C2, С4, C5 и общей средней величине диаметров зон для контрольной концентрации d3 вычисляют с использованием метода наименьших квадратов размеры зон Dmin и Dmах для низкой и высокой концентраций растворов стандартного образца:
Dmin = (3d1 + 2d2 + d3 – d5): 5;
Dmax = (3d5 + 2d4 + d3 – d1): 5,
по которым затем строят стандартную кривую на полулогарифмической сетке расчета биологической активности антибиотиков, откладывая на оси абсцисс величины зон, на оси ординат – соответствующие им концентрации растворов стандартного образца. Разность между найденными средними величинами зон угнетения роста тест-микроба раствором испытуемого образца и раствором контрольной концентрации стандартного образца из тех же чашек прибавляют к значению величины зоны, соответствующей контрольной концентрации на кривой (D3). Затем по кривой находят концентрацию, соответствующую найденной величине зоны. Умножением полученной концентрации на степень разведения получают активность в 1 мл основного раствора или в 1 мг испытуемого образца.
П р и м е р. Средний размер зон для раствора испытуемого образца при разведении
1:300 составляет 18,7 мм, средний размер зон для раствора стандартного образца, содержащего 2 мкг/мл (контрольная концентрация) из тех же чашек – 18,5 мм. Следовательно, разность составляет +0,2 мм. Эту разность прибавляют к величине зоны для раствора в концентрации 2 мкг/мл по стандартной кривой, которая равна D3 = 18,6 мм, и получают величину 18,8 мм. Находят на кривой концентрацию, соответствующую данному размеру зоны – 2,36 мкг/мл. Эту величину умножают на степень разведения и получают содержание активного вещества в 1 мл основного раствора, т.е. 2,36 мкг/мл × 300 = 708 мкг/мг.
Так как концентрация основного раствора составляла 1 мг/мл, то активность испытуемого образца равна 708 мкг/мл: 1 мг/мл = 708 мкг/мл.
Определение активности испытуемого образца расчетным путем. Кри-
вая, отражающая зависимость между активностью антибиотика и размером зоны угнетения роста тест-микроба, после перехода к координатам «логарифм концентрации (lg C) – диаметр зоны (D)» преобразуется в прямую, уравнение которой:
D = а + b × lg C,
где: а – свободный член; b – угловой коэффициент.
По исправленным значениям величин диаметров зон d 1, d 2, d 4, d 5 для растворов стандартного образца с концентрациями C1, C 2, С 4, С 5 и общей средней величине диаметра зоны d 3, соответствующей контрольной С 3, рассчитывают величины а и b с применением метода наименьших квадратов. Так как концентрации С1, С 2, С 3, С 4, C5 составляют геометрическую прогрессию, формулы для вычисления коэффициентов а и b могут быть записаны в виде:

|

|
= (– 2 d 1 – d 2 + d 4 + 2 d 5)/10 × lgZ;

|

|

|

|
a = – lgC3,
где Z – знаменатель прогрессии разведения;

|
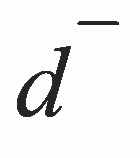
|
= (d 1 + d 2 + d 3 + d 4 + d 5)/5.
П р и м е р. Пусть знаменатель прогрессии разведения Z = 1,25; С3 = 5,0; а средние значения диаметров зон (в мм) равны: d 1 = 17,64; d 2= 18,15; d 3 = 19,03; d 4 = 19,58; d 5 = 20,09.
Тогда:

|

|
= (–2 • 17,64 – 18,15 + 19,58 + 2 • 20,09): (10 × lg 1,25) = 6,33: 0,969 = 6,532;

|
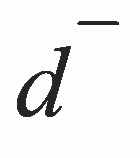
|
= (17,64 + 18,15 + 19,03 + 19,58 + 20,09): 5 = 18,90;
a = 18,90 – 6,532 × 0,6990 = 14,33.
.
Если в опыте с одной стандартной кривой проведено n испытаний образца, то логарифм среднего значения концентрации испытуемого образца в опыте рассчитывают по формуле:
где: CU – среднее значение рабочей концентрации испытуемого образца, полученное по n испытаниям;
– среднее значение диаметра зон задержки роста, полученное по п параллельным испытаниям (3 п чашкам);
– среднее значение соответствующего диаметра для контрольной концентрации, полученное в тех же испытаниях (по 3 п чашки).
В ел и ч и н у ко н ц е н т р а ц и и С U в ы ч и с л я ю т к а к а н т и л о г а р и ф м: С u = a n t i l g (l g С U).
Для получения активности испытуемого образца (А u) величину С U умножают на его разведение в опыте –γ и.
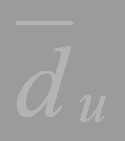
|

|
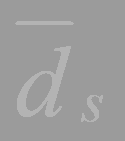
|

|
Пример 2. Пусть n = 3; С3 = 5,0; dS1 = 18,61; dS2 = 18,3; ds3 = 18,12;
du1 = 18,44; du2 = 18,1; du3 = 18,3 при γ и. = 160.
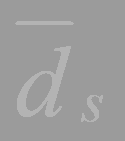
|

|
= (18,61 + 18,3 + 18,12): 3 = 18,34;
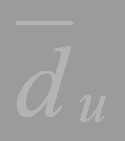
|

|
= (18,44 + 18,1 + 18,3): 3 = 18,28;
lg Сu = 0,6990 + (18,28 – 18,34): 6,532 = 0,6990 – 0,0092 = 0,6898;
С u = antilg(0,6898) = 4,896;
Аu = 4,896·160 = 783.
Поскольку микробиологическое исследование активности антибиотиков подвержено вариабельности, следует проводить не менее 6 повторных испытаний в разные дни (не менее 2 дней), так как средняя активность отдельных определений, проведенных в разные дни, – более надежная величина, чем средняя активность, полученная в результате такого же количества определений, проведенных одновременно.
Расчет ошибки определения логарифма концентрации испытуемого образца в пределах одного опыта приведен в приложении 1 к настоящей статье. Объединение результатов отдельных опытов проводят в соответствии с формулами, приведенными в приложении 2 к настоящей статье.
Во всех сомнительных случаях и при определении активности стандартных образцов должен использоваться только трехдозный вариант метода диффузии в агар.
Для определения содержания активного вещества во флаконе, активность, найденную в 1 мг, умножают на массу содержимого флакона, выраженную в миллиграммах. При исследовании раствора, приготовленного из всего содержимого флакона или ампулы, активность, найденную в 1 мл этого раствора, умножают на его объем. В случае необходимости определения содержания активного вещества в 1 мг испытуемого образца, следует величину, характеризующую содержание активного вещества во флаконе, разделить на массу содержимого флакона, выраженную в миллиграммах.
При определении содержания активного вещества в таблетках или капсулах их количество, а также подготовка для анализа должны соответствовать требованиям общей фармакопейной статьи на данные лекарственные формы. В дальнейшем основной раствор испытуемого образца готовят из расчета 1 мг в 1 мл. После перемешивания раствору дают отстояться или центрифугируют. Рабочий раствор испытуемого образца готовят разведением надосадочной жидкости основного раствора. Для определения содержания активного вещества в 1 таблетке или капсуле активность 1 мг порошка растертых таблеток или содержимого капсул умножают на среднюю массу таблетки или содержимого капсулы, выраженную в миллиграммах.
При исследовании таблеток, покрытых оболочкой, активность определяют в нескольких растворенных таблетках, количество которых и растворитель должны быть указаны в частной фармакопейной статье. Активность, найденную в 1 мл основного раствора, умножают на его объем и делят на количество растворенных в этом объеме таблеток.
Выращивание и хранение культур тест-микробов*. Все культуры тест-микробов сохраняют в запаянных пробирках на соответствующих плотных питательных средах в течение 15-30 сут при температуре от 4 до 10 °С, после чего пересевают на свежую питательную среду. Тест-микробы можно сохранять и в лиофилизированном состоянии.
* Штаммы тест-микробов, за исключением Candida utilis ЛИА-01, применяемые для определения антимикробной активно-
сти антибиотиков, хранятся в музее патогенных и условно патогенных культур при Государственном научно-исследовательском институте стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича. Candida utilis ЛИА-01 хранится во Всесоюзном научно-исследовательском технологическом институте антибиотиков и ферментов медицинского назначения (ВНИТИАФ).
Для характеристики культурных свойств микроорганизмов (см. табл. 33.1)
производится их высев в пробирки с мясо-пептонным бульоном (МПБ), затем через 18-20 ч инкубации при температуре (36 ± 1) °С культуры высевают на чашки Петри с плотной средой для выделения типичных колоний, которые затем пересевают на соответствующие питательные среды для получения в дальнейшем взвесей вегетативных клеток или спор. Взвесь хранят в запаянных стеклянных пробирках при температуре от 4 до 10 °С в течение определенного срока.
В полученной взвеси определяют концентрацию клеток (спор) по оптическому стандарту мутности** или нефелометрически (основная взвесь). Из этой взвеси по мере надобности готовят рабочую взвесь в соответствии с посевной дозой, предусмотренной для каждого тест-микроба.
Культуру тест-микроба Staphylococcus aureus 209P высевают на чашки Петри со средой № 1 и после выращивания в течение 18-20 ч при (36 ± 1) °С, оставляют при комнатной температуре на 24 ч для наблюдения за образованием пигмента. Отбирают типичные колонии и пересевают их в пробирки со скошенным агаром того же состава.
Для определения активности используют взвесь 18-20-часовой культуры стафилококка, выращенной в пробирке на скошенном агаре. Возможно также применение в течение длительного времени взвеси культуры, полученной следующим образом: культуру выращивают в течение 18-20 ч на скошенном агаре в пробирке, смывают ее 5-10 мл стерильного раствора натрия хлорида изотонического 0,9 %. Полученной взвесью засевают матрац с 300 мл среды № 1 (со скошенной поверхностью), выращивают в течение 2 сут [сутки при (36 ± 1) °С и сутки при комнатной температуре], смывают примерно 50 мл стерильного раствора натрия хлорида изотонического 0,9 %. Взвесь культуры можно хранить в запаянных пробирках в течение 5-7 нед. при температуре от 4 до 10 °С.
Культуру тест-микроба Bordetella bronchiseptica (ATCC 4617, гладкая форма) выращивают так же, как указано для Staphylococcus aureus 209P, за исключением времени инкубации, которое составляет для Bordetella bronchiseptica 30-36 ч. Посевным материалом служит культура, выращенная в пробирках со скошенным агаром и хранящаяся при температуре от 4 до 10 °С не более 2 нед. Для длительного применения взвеси клеток культуру смывают с питательной среды 5-10 мл стерильного раствора натрия хлорида изотонического 0,9 %, засевают матрац со средой № 1 (со скошенной поверхностью) и далее поступают так же, как при подготовке культуры Staphylococcus aureus 209Р. Взвесь клеток Bordetella bronchiseptica ATCC 4617 может храниться в течение 7 сут.
Культуру тест-микроба Pseudomonas aeruginosa NCTC 2134 выращивают на чашках Петри со средой № 1 в течение 18-20 ч при температуре (36 ± 1) °С, отбирают типичные колонии, пересевают их на мясо-пептонный бульон с рН от 7,2 до 7,4 и выращивают в вышеуказанных условиях. Полученная культура служит посевным материалом для приготовления суточной культуры, используемой при определении активности в каждом конкретном опыте, и может храниться в течение 30 сут. при температуре от 4 до 10 оС.
** Оптические стандарты мутности и инструкция по их использованию выпускаются и рассылаются Государственным научно- исследовательским институтом стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича.
Культуру тест-микроба Candida utilis ЛИА-01 выращивают на чашках Петри со средой № 3 в течение 48 ч при температуре (30 ± 1) °С, отбирают типичные колонии, пересевают их в пробирки со скошенным агаром того же состава и выращивают в указанных выше условиях. Полученная культура служит посевным материалом для приготовления взвеси клеток, применяемой в течение длительного времени. Для этого культуру с поверхности среды смывают 5-10 мл стерильного раствора натрия хлорида изотонического 0,9 % и засевают матрац с 300 мл среды № 3 (со скошенной поверхностью). Через 2 сут культуру смывают 50 мл стерильного раствора натрия хлорида изотонического 0,9 %. По мере надобности готовят рабочую взвесь, густота которой должна быть такой, чтобы при разведении ее в 30 раз 0,9 % раствором натрия хлорида изотонического оптическая плотность составляла 0,22-0,23. Для определения густоты взвеси используют нефелометр с нейтральным светофильтром и кюветы с толщиной слоя 3 мм. Рабочая взвесь может храниться в течение 30 сут.
При использовании спорообразующих культур тест-микробов процесс выращивания на чашках Петри, отбор типичных колоний, пересев на пробирки со скошенным агаром и на матрацы осуществляют так же, как указано для Staphylococcus aureus 209Р.
Для выращивания культур тест-микробов Вас. subtilis, var. Л2 и Вас. pumilus N CTC 8241 на чашках Петри и пробирках используют среду № 1, при выращивании на матрацах – среду № 4; для выращивания культур тест-микробов Вас.
cereus, var.mycoides HB и Вас. subtilis ATCC 6633 на чашках Петри и пробирках используют среду № 1, при выращивании на матрацах – среду № 5; для выращивания культуры тест-микроб Вас.cereus, var. mycoides 537 на чашках Петри и на пробирках используют среду № 2, при выращивании на матрацах – среду № 4.
Для получения взвеси спор культуру, выращенную в пробирках, смывают
5-10 мл стерильного раствора натрия хлорида изотонического 0,9 %, засевают ею несколько матрацев с 300 мл питательной среды (со скошенной поверхностью) и выращивают в течение 5-7 сут. В процессе выращивания периодически производят микроскопический контроль культуры, и если в мазках, окрашенных по Граму, имеется в поле зрения 80-90 % спор, производят смыв стерильной дистиллированной водой.
Полученную взвесь спор прогревают при температуре от 60 до 70 °С в течение 30 мин. Затем промывают стерильной дистиллированной водой при центрифугировании до полной прозрачности надосадочной жидкости. Промытую взвесь спор вновь прогревают в течение 30 мин при температуре от 60 до 70 °С. Взвесь спор хранят в запаянных стеклянных пробирках при температуре от 4 до 10 °С и используют до тех пор, пока интенсивность роста и четкость зон при определении антимикробной активности препаратов удовлетворяют предъявляемым требованиям.
Для заражения питательных сред допускается использование лиофилизированных тест-культур с точно известным содержанием количества микробных клеток (спор) в ампуле, которые после суспендирования в соответствующем растворителе (изотоническом растворе натрия хлорида 0,9 % или дистиллированной воде) вносят в питательную среду без предварительного пересева.
Таблица 33.3
|
Состав питательных сред для выращивания тест-культур, получения спор и определения активности антибиотиков
*1000 мл
Питательные среды и буферные растворы. В табл. 33.3 представлен состав сред, используемых при определении активности антибиотиков.
Для приготовления сред № 4, 5, 6, 7, 8, 9, 10, 13, 14, 15, 16 применяют ферментативный гидролизат биомассы микроорганизмов без оболочек. Методика приготовления состоит в следующем: 5 г сухого ферментативного гидролизата размешивают в 1 л дистиллированной воды, прибавляют агар-агар, расплавленный в открытом котле или автоклаве текучим паром или под давлением 0,05 МПа и температуре (111 ± 1) ºС в течение 30 мин. В случае необходимости в среду прибавляют соли в количестве, указанном в прописи сред; рН сред определяют потенциометрически со стеклянными электродами или колориметрически. рН корригируют хлористоводородной кислотой или раствором натрия гидроксида.
Готовые среды разливают в соответствующую посуду и стерилизуют в автоклаве при 0,1 МПа и температуре (120 ± 1) ºС в течение 15 мин.
Мясо-пептонный бульон (среда № 1) готовят на водопроводной воде обычным способом, изложенным в руководствах по микробиологии.
Примечания
1. Количество агар-агара в средах указано для цилиндрочашечной модификации. В случае применения лунок количество агар-агара увеличивают до 20-25 г на 1000 мл среды.
2. Допускается уменьшение или увеличение содержания агар-агара в средах в зависимости от его качества.
3. Допускается использование взамен сред с ферментативным гидролизатом биомассы микроорганизмов (без оболочек) сред с другими источниками аминного азота:
а) сухих сред на основе сухого рыбного бульона. При использовании данной среды в отдельных случаях необходимо изменение посевной дозы тест-микроба и увеличение концентрации растворов стандартных и испытуемых образцов;
б) сред на основе панкреатического гидролизата мяса (по Хоттингеру) глубокого расщепления. Среды № 6, 7, 8, 10 должны содержать 130-140 мг% аминного азота, а среды № 4, 5, 9, 13 – 30-35 мг% аминного азота. Для приготовления сред с гидролизатом мяса применяют дистиллированную воду. Панкреатический гидролизат мяса и среды на его основе готовят обычным способом, изложенным в руководствах по микробиологии. Условия проведения анализа на средах с панкреатическим гидролизатом не отличаются от условий проведения анализа на средах с ферментативным гидролизатом биомассы микроорганизмов без оболочек.
При контроле активности антибиотиков применяются буферные растворы, состав которых приведен в табл. 33.4.
Таблица 33.4
Date: 2016-05-25; view: 538; Нарушение авторских прав