
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ішкі үйкеліс құбылысы
|
|
Сұйық немесе газ қабаттары бір-біріне қатысты қозғалған жағдайда олардың арасында үйкеліс күші пайда болады. Бұл құбылыс ішкі үйкеліс құбылысы деп аталады.
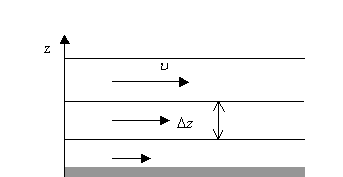
| Ішкі үйкеліс кезінде газдың бір қабатынан екінші қабатына импульс (қозғалыс мөлшері) тасымалданады.
 - жылдамдық градиенті.
Ішкі үйкеліс құбылысын сипаттайтын заңды ағылшын - жылдамдық градиенті.
Ішкі үйкеліс құбылысын сипаттайтын заңды ағылшын
|
ғалымы Ньютон ашты. Сондықтан бұл заң ішкі үйкеліс құбылысы үшін Ньютон заңы деп аталады:
 немесе
немесе 
мұндағы: 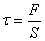 -кернеу,
-кернеу, 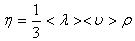 -ішкі үйкеліс коэффициенті немесе тұтқырлық, өлшем бірлігі
-ішкі үйкеліс коэффициенті немесе тұтқырлық, өлшем бірлігі 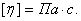
Нақты газдар
Менделеев-Клапейрон теңдеуі молекулалары бір-бірімен әсерлеспейтін және нүкте деп қарастырылатын идеал газдардың күйін анықтайды. Нақты газдардың молекуларының өлшемдері болады және олар бір-бірімен өзара әсерлеседі. Нақты газдардың күйін анықтайтын теңдеуді алу үшін голланд ғалымы Ван-дер-Ваальс Менделеев-Клапейрон теңдеуіне молекулаларды өлшемдерін және өзара әсерлесуін ескеретін түзету енгізді. Бұл алынған теңдеу нақты газдардың күй теңдеуі немесе Ван-дер-Ваальс теңдеуі деп аталады. Мөлшері 1 моль нақты газ үшін Ван-дер-Ваальс теңдеуі келесі түрде жазылады:
 ,
,
мұндағы:  -Ван-дер-Ваальс тұрақтылары, өлшем бірліктері
-Ван-дер-Ваальс тұрақтылары, өлшем бірліктері  ,
,  .
.
Бірінші жақша ішіндегі  түзетуі молекулалардың арасындағы тартылыс күшінің әсерінен пайда болады. Оны кейде ішкі қысым деп атайды.
түзетуі молекулалардың арасындағы тартылыс күшінің әсерінен пайда болады. Оны кейде ішкі қысым деп атайды.  түзетуі молекулалардың өлшемдерін ескереді. Кез-келген мөлшердегі нақты газ үшін Ван-дер-Ваальс теңдеуі
түзетуі молекулалардың өлшемдерін ескереді. Кез-келген мөлшердегі нақты газ үшін Ван-дер-Ваальс теңдеуі  екенін ескере отырып келесі түрде жазылады:
екенін ескере отырып келесі түрде жазылады:
 немесе
немесе  .
.
Нақты газдардың ішкі энергиясы  өрнегімен анықталады, мұндағы
өрнегімен анықталады, мұндағы 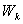 - молекулалардың қосынды кинетикалық энергиясы,
- молекулалардың қосынды кинетикалық энергиясы,  -молекулалардың қосынды өзара әсерлесу энергиясы.
-молекулалардың қосынды өзара әсерлесу энергиясы.  энергиясын анықтайық. Ол үшін молекулалардың арасындағы тартылу күшінің жұмысы
энергиясын анықтайық. Ол үшін молекулалардың арасындағы тартылу күшінің жұмысы  энергиясының кемуіне тең екенін ескереміз, яғни
энергиясының кемуіне тең екенін ескереміз, яғни  . Молекулалардың арасындағы тартылу күші
. Молекулалардың арасындағы тартылу күші  ішкі қысыммен сипатталады. Сондықтан
ішкі қысыммен сипатталады. Сондықтан 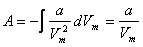 және
және  .
.
Молекулалардың қосынды 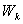 кинетикалық энергиясы олардың қозғалысына тәуелді болады.
кинетикалық энергиясы олардың қозғалысына тәуелді болады.
Сондықтан Ван-дер-Ваальс газының 1 молінің ішкі энергиясы
 ,
,
мұндағы:  .
.
Date: 2016-05-18; view: 2243; Нарушение авторских прав