
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примерный комплект заданий для рубежного контроля
|
|
по дисциплине «Химия»
РК 1.
Вариант 1
1. Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РH3, H2О, НВr.
2. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
3. Исходя из положения германия и технеция в периодической системе, составьте формулы мета-, ортогерманиевой кислот и оксида технеция, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
4. Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
5. Внутренняя энергия и энтальпия систем. Первый закон термодинамики.
6. Окисление серы и ее диоксида протекает по уравнениям:
а) S(к) + O2 =SO2(к);
б) 2SO2(г) + O2 = 2SO3(г)
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
Вариант 2
1. В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН?
2. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
3. Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s - и р -элементов в группах периодической системы с увеличением порядкового номера? Почему?
4. Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов, определите, какая из связей: HCI, HBr, HI – наиболее полярна.
5. Тепловой эффект химической реакции. Термохимические уравнения процессов. Энтальпии образования химических соединений.
6. Напишите выражение для константы равновесия гомогенной системы
N2 +3Н2 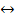 2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в три раза?
2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в три раза?
Вариант 3
1. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалентную массу этого металла.
2. Какое максимальное число электронов могут занимать s-, р-, d- и f -орбитали данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером 31.
3. Что такое электроотрицательность? Как изменяется электроотрицательность р -элементов в периоде, в группе периодической системы с увеличением порядкового номера? Почему?
4. Какой способ образования ковалентной связи называют донорно-акцепторным? Какие химические связи имеются в ионах NH4+ и ВF4-? Укажите донор и акцептор.
5. Закон Гесса и следствия из него.
6. Реакция идет по уравнению N2 + О2 ↔2NO. Концентрации исходных веществ до начала реакции были: [N2] = 0,049 моль/л; [О2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] = 0,005 моль/л.
Вариант 4
1. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла.
2. Напишите электронные формулы атомов элементов с порядковыми номерами 25 и 34. К какому электронному семейству относится каждый из этих элементов?
3. Исходя из положения германия, молибдена и рения в периодической системе, составьте формулы водородного соединения германия, оксида молибдена и рениевой кислоты, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
4. Какую ковалентную связь называют -связью и какую  -связью? Разберите на примере строения молекулы азота.
-связью? Разберите на примере строения молекулы азота.
5. Понятие об энтропии и ее изменении в химических превращениях.
6. Реакция идет по уравнению N2 + 3H2 ↔2NH3. Концентрации участвующих в ней веществ были: [N2] = 0,80 моль/л; [H2] = 1,5 моль/л; [NH3] = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л.
7. Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора НNО3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора?
Вариант 5
1. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента.
2. Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4р? Почему? Напишите электронную формулу атома элемента с порядковым номером 21.
3. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента.
4. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами?
5. Энергия Гиббса и ее изменение в химических процессах. Критерий самопроизвольного протекания химических реакций в изобарно-изотермических условиях.
6. Реакция идет по уравнению Н2 + I2 ↔ 2НI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [Н2] = 0,04 моль/л; [I2] = 0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [Н2] = 0,03 моль/л.
РК 2.
Вариант №1
1. Найти массовую долю глюкозы в растворе, содержащем 280 г воды и 40 г глюкозы.
2. При какой приблизительно температуре будет кипеть 50%-ный (по массе) раствор сахарозы C12H22011?
3. Константа диссоциации масляной кислоты С3Н7СООН 1,5 ·10-5. Вычислить степень её диссоциации в 0,005 М растворе.
4. Написать в ионно-молекулярной форме уравнения реакций:
a. Pb(NO3)2 + KI =
b. Na2S + H2SO4 =
5. Найти рН раствора, в котором концентрация гидроксид-ионов (в моль/л) составляет 10-4.
6. Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, CuCl2, KNO3. Для каждой из гидролизующихся солей написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза, указать реакцию водного раствора соли. Для первой ступени написать выражение константы гидролиза.
7. В приведенных уравнениях окислительно-восстановительных реакций определите окислитель и восстановитель, составьте уравнение электронного баланса, определите процессы окисления и восстановления, расставьте коэффициенты.


8. Укажите катод и анод в заданном гальваническом элементе, запишите уравнения реакций, протекающих у электродов, составьте уравнение суммарной реакции. Вычислите ЭДС заданного гальванического элемента при соответствующих концентрациях потенциалопределяющих ионов.
| Mg | MgSO4 || NiSO4 | Ni | [Mg2+]=0,1; [Ni2+]=1 |
Вариант №2
1. Сколько граммов Na2SO3 потребуется для приготовления 5 л 8 % раствора (ρ = 1,075 г/мл)?
2. Вычислить осмотическое давление раствора, содержащего 16 г сахарозы С12Н22О11 в 350 г Н20 при 293 К. Плотность раствора считать равной единице.
3. Сколько йодида свинца (ПРPbI2 = 8 · 10-9) может растворится в 150 мл воды?
4. Написать в ионно-молекулярной форме уравнения реакций:
a. HCl + Ba(OH)2 =
b. NiCl2 + H2S =
5. Найти рН раствора, в котором концентрация гидроксид-ионов (в моль/л) составляет 3,2·10-6.
6. При смешивании водных растворов хлорида алюминия и сульфида натрия образуется осадок и выделяется газ. Написать уравнение реакции и объяснить происходящее.
7. В приведенных уравнениях окислительно-восстановительных реакций определите окислитель и восстановитель, составьте уравнение электронного баланса, определите процессы окисления и восстановления, расставьте коэффициенты.

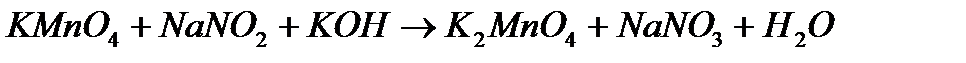
8. Укажите катод и анод в заданном гальваническом элементе, запишите уравнения реакций, протекающих у электродов, составьте уравнение суммарной реакции. Вычислите ЭДС заданного гальванического элемента при соответствующих концентрациях потенциалопределяющих ионов.
| Zn | ZnSO4 || CdSO4 | Cd | [Zn2+]=0,1; [Cd2+]=1 |
Вариант №3
1. 1 мл 25 % раствора содержит 0,458 г растворенного вещества. Какова плотность этого раствора?
2. Сколько граммов сахарозы C12H22011 надо растворить в 100 г воды, чтобы: а) понизить температуру кристаллизации на 1 градус? б) повысить температуру кипения на 1 градус?
3. Степень диссоциации муравьиной кислоты НСООН в 0,2 н. растворе равна 0,03.Определить константу диссоциации кислоты и значение рК.
4. Написать в ионно-молекулярной форме уравнения реакций:
FeS↓ + HCl =
HF + KOH =
5. Найти рН раствора, в котором концентрация гидроксид-ионов (в моль/л) составляет 7,4·10-11.
6. Какие из перечисленных ниже солей подвергаются гидролизу:Pb(NO3)3, KBr, KClO. Для каждой из гидролизующихся солей написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза, указать реакцию водного раствора соли. Для первой ступени написать выражение константы гидролиза.
7. В приведенных уравнениях окислительно-восстановительных реакций определите окислитель и восстановитель, составьте уравнение электронного баланса, определите процессы окисления и восстановления, расставьте коэффициенты.


8. Укажите катод и анод в заданном гальваническом элементе, запишите уравнения реакций, протекающих у электродов, составьте уравнение суммарной реакции. Вычислите ЭДС заданного гальванического элемента при соответствующих концентрациях потенциалопределяющих ионов.
| Mn | MnSO4 || ZnSO4 | Zn | [Mn2+]=1; [Zn2+]=0,01 |
Вариант №4
1. Из 400 г 50 % раствора H2SO4 выпариванием удалили 100 г воды. Чему равна массовая доля H2SO4 в оставшемся растворе?
2. К 100 мл 0,5 М водного раствора сахарозы С12Н22О11 добавлено 300 мл воды. Чему равно осмотическое давление полученного раствора при 25° С?
3. Чему равно ПРZn(OH)2, если известно, что растворимость его составляет 2,2 · 10-5?
4. Написать в ионно-молекулярной форме уравнения реакций:
K2CO3 + HCl =
Fe(OH)3↓+ HNO3 =
5. Найти рОН в водном растворе, в котором концентрация ионов водорода (в моль/л) равна 10-3.
6. Можно ли в растворе соли хлорида олова (II), подвергающегося гидролизу, предотвратить гидролиз? Как это сделать?
7. В приведенных уравнениях окислительно-восстановительных реакций определите окислитель и восстановитель, составьте уравнение электронного баланса, определите процессы окисления и восстановления, расставьте коэффициенты.
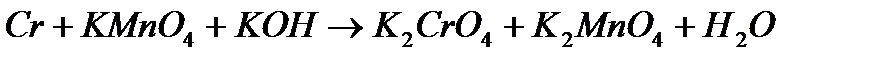

8. Укажите катод и анод в заданном гальваническом элементе, запишите уравнения реакций, протекающих у электродов, составьте уравнение суммарной реакции. Вычислите ЭДС заданного гальванического элемента при соответствующих концентрациях потенциалопределяющих ионов.
| Cd | CdSO4 || CuSO4 | Cu | [Cd2+]=0,1; [Cu2+]=0,5 |
Вариант №5
1. При 25 °С растворимость NaCl равна 36 г в 100 г воды. Найти массовую долю NaCl в насыщенном растворе.
2. В радиатор автомобиля налили 9 л воды и прибавили 2 л метилового спирта (р = 0,8 г/мл). При какой наинизшей температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет?
3. При какой концентрации раствора степень диссоциации азотистой кислоты HNO2 будет равна 0,2? (Кд(HNO2) = 4·10-4)
4. Написать в ионно-молекулярной форме уравнения реакций:
HCOOK + HNO3 =
CuSO4 + NaOH =
5. Найти рОН в водном растворе, в котором концентрация ионов водорода (в моль/л) равна 6,5·10-8.
6. Какие из перечисленных ниже солей подвергаются гидролизу:Sn(NO3)2, Na3PO4, SrBr2. Для каждой из гидролизующихся солей написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза, указать реакцию водного раствора соли. Для первой ступени написать выражение константы гидролиза.
7. В приведенных уравнениях окислительно-восстановительных реакций определите окислитель и восстановитель, составьте уравнение электронного баланса, определите процессы окисления и восстановления, расставьте коэффициенты.


8. Укажите катод и анод в заданном гальваническом элементе, запишите уравнения реакций, протекающих у электродов, составьте уравнение суммарной реакции. Вычислите ЭДС заданного гальванического элемента при соответствующих концентрациях потенциалопределяющих ионов.
| Cu | Cu SO4 || AgNO3 | Ag | [Cu2+]=0,1; [Ag+]=0,5 |
Преподаватель_____________________Таутиева М.А
Вопросы для обсуждения на семинарских (практических) занятиях
по дисциплине «Химия»
Date: 2016-05-17; view: 634; Нарушение авторских прав