
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Задание 4. Растворы. Электролитическая диссоциация. Ионное произведение воды. Водородный показатель. Гидролиз солей
|
|
4.1. Приготовление растворов. Виды концентраций.
1. Найти массовую долю глюкозы в растворе, содержащем 280 г воды и 40 г глюкозы.
2. Для приготовления 5 % раствора MgSO4 взято 400 г MgSO4·7 H2O. Найти массу полученного раствора.
3. Сколько миллилитров концентрированной соляной кислоты (ρ = 1,19 г/мл), содержащей 38% НСl, нужно взять для приготовления 1 л 2 н. раствора?
4. Сколько граммов Na2SO3 потребуется для приготовления 5 л 8 % раствора (ρ = 1,075 г/мл)?
5. Сколько молей MgSO4·7 H2O надо прибавить к 100 молям воды, чтобы получить 10 % раствор MgSO4.
6. Какой объём 2 М раствора Na2CO3 надо взять для приготовления 1 л 0,25 н. раствора?
7. 1 мл 25 % раствора содержит 0,458 г растворенного вещества. Какова плотность этого раствора?
8. Определить массовую долю CuSO4 в растворе, полученном при растворении 50 г медного купороса CuSO4 ·5H2O в 450 г воды.
9. Какой объём 0,05 н. раствора можно получить из 100 мл 1 н. раствора?
10. Из 400 г 50 % раствора H2SO4 выпариванием удалили 100 г воды. Чему равна массовая доля H2SO4 в оставшемся растворе?
11. В какой массе воды нужно растворить 25 г CuSO4 ·5H2O, чтобы получить 8 % раствор CuSO4?
12. Какой объём 2 н. раствора H2SO4 потребуется для приготовления 500 мл 0,5 н. раствора?
13. При 25 °С растворимость NaCl равна 36 г в 100 г воды. Найти массовую долю NaCl в насыщенном растворе.
14. Сколько граммов Na2SO4·10 H2O надо растворить в 800 г воды, чтобы получить 10 % раствор Na2SO4?
15. Найти массу воды, необходимую для приготовления раствора хлорида натрия, содержащего 1,5 моля NaCl на 1000 г H2O, если имеется 10 г NaCl.
16. Сколько граммов 30% раствора NaCl нужно добавить к 300 г воды, чтобы получить 10 % раствор соли?
17. Сколько граммов Na2CO3 содержится в 500 мл 0,25 н. раствора?
18. Плотность 9 % раствора сахарозы С12Н22О11 равна 1,035 г/мл. Вычислить: а) концентрацию сахарозы в г/л; б) молярность; в) моляльность раствора.
19. В какой массе воды надо растворить 67,2 л HCl (н.у), чтобы получить 9 % раствор HCl?
20. Найти массу NaNO3, необходимую для приготовления 300 мл 0,2 М раствора.
21. Плотность 15 % раствора H2SO4 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
22. Сколько граммов 2 % раствора AgNO3 дадут при взаимодействии с избытком NaCl 14,35 г осадка AgCl?
23. В каком объёме 0,1 н. раствора содержится 8 г CuSO4?
24. Плотность 15 % раствора H2SO4 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
25. Какую массу 20% раствора KOH надо добавить к 1 кг 50% раствора, чтобы получить 25% раствор?
4.2. Напишите уравнения реакций в водных растворах электролитов (табл.6):
Таблица 6
| № | В молекулярной и ионно-молекулярной форме | В молекулярной форме |
| K2CO3+HCl= | 
| |
| Na2SO3+H2SO4= | 
| |
| Pb(NO3)2+KI= | 
| |
| NiCl2+H2S= | 
| |
| CrSO4+NaOH= | 
| |
| AlBr3+AgNO3= | 
| |
| Na2S+H2SO4= | 
| |
| HCOOK+HNO3= | 
| |
| NH4Cl+Ca(OH)2= | 
| |
| NaClO+HNO3= | 
| |
| FeS+HCl= | 
| |
| HCl+Ba(OH)2= | 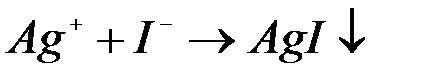
| |
| CH3COOH+NH4OH= | 
| |
| HNO2+NH4OH= | 
| |
| NaHCO3+HCl= | 
| |
| FeCl3+KOH= | 
| |
| Pb(CH3COO)2+Na2S= | 
| |
| KHS+H2SO4= | 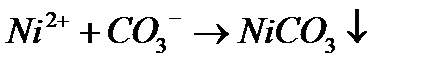
| |
| Cr2(SO4)3+KOH= | 
| |
| NiCl2+K2CO3= | 
| |
| MnSO4+Mg(OH)2= | 
| |
| NaHCO3+Ca(OH)2= | 
| |
| H2CrO4+BaCl2= | 
| |
| H3PO4+CaCl2= | 
| |
| Na2ZnO2+HCl= | 
|
4.3. Вычислить рН растворов:
| Вариант | Раствор | Ответ |
| NaOH, массовая доля 0,2 % | 12,7 | |
| КОН, массовая доля 0,19 % | 12,47 | |
| HCl, массовая доля 0,36 % | 1,0 | |
| HNO3, массовая доля 0,32 % | 1,3 | |
| H2SO4. массовая доля 0,4 % | 1,1 | |
| NaOH, плотность 1,002 г/см3 | 12,95 | |
| КОН, плотность 1,004 г/см3 | 13,0 | |
| HCl, плотность 1,000 г/см3 | 1,0 | |
| HNO3, плотность 1,003 г/см3 | 1,7 | |
| H2SO4, плотность 1,005 г/см3 | 0,7 | |
| 0,1 M HNO2; K = 6,9×10-4 | 2,1 | |
| 0,2 M HCN; K=5×10-10 | 5,0 | |
| 0,01 M HCOOH; K=1,8×10-4 | 2,9 | |
| 0,02 M CH3COOH; K=1,74×10-5 | 3,24 | |
| 0,5 M NH4OH; K=1,76×10-5 | 11,03 | |
| NaOH, массовая доля 0,2 % | 12,7 | |
| КОН, массовая доля 0,19 % | 12,47 | |
| HCl, массовая доля 0,36 % | 1,0 | |
| HNO3, массовая доля 0,32 % | 1,3 | |
| H2SO4. массовая доля 0,4 % | 1,1 | |
| NaOH, плотность 1,002 г/см3 | 12,95 | |
| КОН, плотность 1,004 г/см3 | 13,0 | |
| HCl, плотность 1,000 г/см3 | 1,0 | |
| HNO3, плотность 1,003 г/см3 | 1,7 | |
| H2SO4, плотность 1,005 г/см3 | 0,7 |
4.4. Написать уравнения реакций гидролиза солей в молекулярной и ионно-молекулярной формах. Вычислить Кгидр., степень гидролиза и рН в растворах солей:
| № | Соль | Концентрация, моль/дм3 или % | Кдис. | рКдис. |
| (CH3COO)2Mg | 0,1 % | 1,74 ∙ 10–5 | 4,76 | |
| Na2CO3 | 0,1 M | 4,8 ∙ 10–11 | 10,32 | |
| NH4NO3 | 0,15 % | 1,76 ∙ 10–5 | 4,755 | |
| (NH4)2CO3 | 0,03 M | 1,76 ∙ 10–5 4,8 ∙ 10–11 | 4,755 10,32 | |
| Na2S | 0,05 M | 2,5 ∙ 10–15 | 12,60 | |
| CuCl2 | 1 % | 2,2 ∙ 10–20 | 19,66 | |
| C6H5COONa | 1,5 % | 6,3 ∙ 10–5 | 4,20 | |
| Zn(NO3)2 | 0,15 M | 1,2 ∙ 10–17 | 16,92 | |
| (NH4)2S | 0,01 M | 1,76 ∙ 10–5 2,5 ∙ 10–15 | 4,755 12,60 | |
| C2H5COOK | 0,2 % | 1,74 ∙ 10–5 | 4,76 | |
| Na3PO4 (по 1-й ступени) | 0,5 % | 7,1 ∙ 10–3 | 2,15 | |
| FeCl3 | 0,2 M | 3,8 ∙ 10–38 | 37,42 | |
| HCOOK | 0,01 M | 1,8 ∙ 10–4 | 3,75 | |
| Cr(NO3)3 | 0,5 % | 6,3 ∙ 10–31 | 30,20 | |
| MnBr2 | 0,3 % | 2,05 ∙ 10–13 | 12,69 | |
| (CH3COO)2Mg | 0,1 % | 1,74 ∙ 10–5 | 4,76 | |
| Na2CO3 | 0,1 M | 4,8 ∙ 10–11 | 10,32 | |
| NH4NO3 | 0,15 % | 1,76 ∙ 10–5 | 4,755 | |
| (NH4)2CO3 | 0,03 M | 1,76 ∙ 10–5 4,8 ∙ 10–11 | 4,755 10,32 | |
| Na2S | 0,05 M | 2,5 ∙ 10–15 | 12,60 | |
| CuCl2 | 1 % | 2,2 ∙ 10–20 | 19,66 | |
| C6H5COONa | 1,5 % | 6,3 ∙ 10–5 | 4,20 | |
| Zn(NO3)2 | 0,15 M | 1,2 ∙ 10–17 | 16,92 | |
| (NH4)2S | 0,01 M | 1,76 ∙ 10–5 2,5 ∙ 10–15 | 4,755 12,60 | |
| C2H5COOK | 0,2 % | 1,74 ∙ 10–5 | 4,76 |
Date: 2016-05-17; view: 754; Нарушение авторских прав