
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уравнение Ван-дер-Ваальса
|
|
Как показывают эксперименты, модель идеального газа позволяет описывать поведение разреженных реальных газов лишь при «нормальных» условиях, т.е. при достаточно низком давлении и высокой температуре. При высоких давлениях, или низких температурах уравнение состояния дает большие расхождения с результатами экспериментов.
При выводе уравнения состояния идеального газа не учитывались размеры молекул и потенциальная энергия их взаимодействия. Поэтому физическая природа газа не играла никакой роли и уравнение состояния универсально и применимо ко всем газам. Повышение давления приводит к уменьшению среднего расстояния между молекулами, значит, необходимо учитывать объем молекул и взаимодействие между ними.
Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, Ван-дер-Ваальс вывел уравнение состояния реального газа, введя в уравнение Клапейрона-Менделеева две поправки.
1. Учет собственного объема молекул.
Для движения молекул предоставлен не весь объем  , занимаемый газом, а меньший на величину объема всех молекул газа ‑
, занимаемый газом, а меньший на величину объема всех молекул газа ‑  , где
, где  ‑ суммарный объем молекул газа,
‑ суммарный объем молекул газа,  - молярный объем. Расчеты показывают, что константа
- молярный объем. Расчеты показывают, что константа  численно равна учетверенному объему молекул, содержащихся в моле газа. Размерность поправки
численно равна учетверенному объему молекул, содержащихся в моле газа. Размерность поправки  .
.
2. Учет притяжения молекул.
Действие сил притяжения молекул газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. Внутреннее давление  равно
равно
 ,
,
где  – постоянная Ван-дер-Ваальса, характеризующая силы притяжения молекул. Размерность коэффициента:
– постоянная Ван-дер-Ваальса, характеризующая силы притяжения молекул. Размерность коэффициента:  .
.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
 (23)
(23)
Для произвольного количества вещества  газа с учетом того, что
газа с учетом того, что  , уравнение (23) имеет вид:
, уравнение (23) имеет вид:

где поправки  и
и 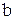 - постоянные для каждого газа величины, определяемые опытным путем.
- постоянные для каждого газа величины, определяемые опытным путем.
Date: 2016-05-15; view: 543; Нарушение авторских прав