
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Элементы термодинамики
|
|
Внутренняя энергия системы и способы ее изменения. Внутренняя энергия идеального одноатомного газа и ее изменение. Виды теплопередачи. Количество теплоты. Удельная и молярная теплоемкость вещества. Работа в термодинамике.
Внутренняя энергия тела – сумма кинетических энергий теплового движения всех молекул относительно центра масс тела и потенциальных энергий взаимодействия всех молекул друг с другом.
Способы изменения внутренней энергии тела: 1) совершение над телом механической работы; 2) теплопередача (теплообмен).
Внутренняя энергия идеального одноатомного газа:  , где
, где 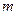 – масса газа,
– масса газа,  – молярная масса газа, T – абсолютная температура газа, R = 8,31Дж/(моль
– молярная масса газа, T – абсолютная температура газа, R = 8,31Дж/(моль  К) – универсальная газовая постоянная.
К) – универсальная газовая постоянная.
Изменение внутренней энергии одноатомного идеального газа: 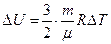 .
.
Виды теплопередачи (теплообмена): 1) теплопроводность; 2) конвекция; 3) излучение.
Количество теплоты – количественная мера изменения внутренней энергии при теплопередаче (теплообмене).
Единица количества теплоты в СИ: 1 Дж.
Внесистемная единица количества теплоты: 1 кал (калория); 1 кал = 4,19 Дж.
Формула для расчета количества теплоты, необходимого для нагревания (выделяемого при охлаждении) тела:  ,где m – масса тела, с – удельная теплоемкость вещества, из которого изготовлено тело,
,где m – масса тела, с – удельная теплоемкость вещества, из которого изготовлено тело,  – конечная температура тела,
– конечная температура тела, 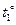 – начальная температура тела, Δto =
– начальная температура тела, Δto =  разность температур.
разность температур.
Формула для расчета количества теплоты, необходимого для плавления (выделяемого при отвердевании) кристаллического тела: Q = mλ,гдеm – масса тела, λ – удельная теплота плавления (кристаллизации).
Формула для расчета количества теплоты, необходимого для превращения жидкости в пар (выделяемого при конденсации пара): Q = mL,где m – масса жидкости (пара),  –удельная теплота парообразования (конденсации).
–удельная теплота парообразования (конденсации).
Формула для расчета количества теплоты, выделяемого при сгорании топлива:
Q = mq,где m – масса топлива, q – удельная теплота сгорания топлива.
 Удельная теплоемкость вещества – количество теплоты, которое получает или отдает 1 кг вещества при изменении его температуры на 10С.
Удельная теплоемкость вещества – количество теплоты, которое получает или отдает 1 кг вещества при изменении его температуры на 10С.
Молярная теплоемкость вещества – количество теплоты, которое получает или отдает 1 моль вещества при изменении его температуры на 10С.
Соотношение между молярной и удельной теплоемкостью вещества: Cm = cm, где с– удельная теплоемкость вещества, m – молярная масса вещества, Cm – молярная теплоемкость.
Теплоёмкость тела – количество теплоты, которое получает или отдаёт тело при изменении его температуры на 1оС.
Соотношение между теплоёмкостью тела и удельной теплоемкостью вещества, из которого оно состоит: C = cm, где с– удельная теплоемкость вещества, m – масса тела.
Формула для расчета механической работы в термодинамике: 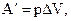 где р – давление (как правило, газа), DV – изменение объема.
где р – давление (как правило, газа), DV – изменение объема.
Положительный знак работы газа при его расширении ( > 0) и отрицательный знак работы газа при его сжатии (
> 0) и отрицательный знак работы газа при его сжатии ( < 0). Передача газом энергии окружающим телам при расширении и получение газом энергии от окружающих тел при сжатии.
< 0). Передача газом энергии окружающим телам при расширении и получение газом энергии от окружающих тел при сжатии.
A = – A' = – pΔV – работа внешних сил над газом.
Геометрическое истолкование работы: работа газа в каком-либо процессе численно равна площади фигуры, ограниченной графиком процесса на плоскости р, V, осью V и отрезками, равными давлениями р1 и р2 в начальном и конечном состоянии (рис. 17).
Закон сохранения энергии в тепловых процессах (первый закон термодинамики). Уравнение теплового баланса. Применение первого закона термодинамики к изопроцессам в идеальном газе. Теплоемкость идеального одноатомного газа при постоянном объеме и постоянном давлении. Адиабатический (адиабатный) процесс
Две формулировки первого закона термодинамики:
1. Количество теплоты, сообщенное термодинамической системе, идет на 1) изменение ее внутренней энергии и 2) совершение системой работы над внешними телами ( ).
).
2. Внутренняя энергия термодинамической системы изменяется при 1) сообщении ей количества теплоты и 2) совершении над системой механической работы (DU = Q + A).
Уравнение теплового баланса: алгебраическая сумма (т.е. взятая с учетом знака) количеств теплоты, полученных или отданных телами в процессе теплообмена в теплоизолированной системе (в случае отсутствия механической работы) равна нулю 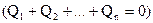 .
.
Первый закон термодинамики в применении к изопроцессам в идеальном газе:
1. Изотермический процесс:  (
( ,
, 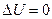 )
)
2. Изобарический процесс:  .
.
3. Изохорический процесс:  (
( ,
,  ,
,  )
)
Удельная теплоемкость идеального одноатомного газа при постоянном объеме:
 ,где
,где  – молярная масса газа, R = 8,31Дж/(моль
– молярная масса газа, R = 8,31Дж/(моль  К) – универсальная газовая постоянная.
К) – универсальная газовая постоянная.
Удельная теплоемкость идеального одноатомного газа при постоянном давлении:
 .
.
Адиабатический (адиабатный) процесс – процесс в термодинамической системе, протекающий без теплообмена с окружающими телами (с окружающей средой). Такую систему называют теплоизолированной.
Первый закон термодинамики в применении к адиабатическому процессу:
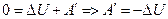
В адиабатическом (адиабатном) процессе система совершает работу над внешними телами за счет убыли своей внутренней энергии.
Тепловой двигатель. Виды тепловых двигателей. Принцип действия тепловых двигателей. Идеальный тепловой двигатель. Коэффициент полезного действия тепловых двигателей и его максимальное значение (теорема Карно). Необратимость тепловых процессов. Тепловые двигатели и охрана окружающей среды
Тепловой двигатель – устройство, превращающее внутреннюю энергию обычного или ядерного топлива в механическую работу.
 Виды тепловых двигателей: 1) паровая машина; 2) двигатель внутреннего сгорания; 3) паровая турбина; 4) реактивный двигатель.
Виды тепловых двигателей: 1) паровая машина; 2) двигатель внутреннего сгорания; 3) паровая турбина; 4) реактивный двигатель.
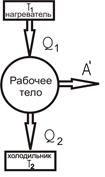
Принцип действия тепловых двигателей: 1) повышение температуры рабочего тела при сгорании топлива до температуры нагревателя Т1; 2) совершение рабочим телом механической работы при расширении; 3) потеря рабочим телом энергии при совершении механической работы и охлаждение при этом до температуры холодильника Т2 (холодильником является атмосфера или специальные устройства для охлаждения и конденсации отработанного пара – конденсаторы). Принципиальная схема теплового двигателя представлена на рис. 18.
|
Формула для расчета КПД тепловых двигателей:
 ,где Q1 – модуль количества теплоты, полученного рабочим телом от нагревателя, Q2 – модуль количества теплоты, отданного рабочим телом холодильнику, A' – работа, совершенная тепловым двигателем.
,где Q1 – модуль количества теплоты, полученного рабочим телом от нагревателя, Q2 – модуль количества теплоты, отданного рабочим телом холодильнику, A' – работа, совершенная тепловым двигателем.
Идеальный тепловой двигатель – тепловой двигатель, в котором рабочим телом является идеальный газ.
Цикл Карно – замкнутый цикл, состоящий из двух изотерм и двух адиабат, совершаемый идеальным газом.
Формула для расчета КПД идеального теплового двигателя: 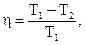 где Т1 – температура нагревателя, Т2 – температура холодильника.
где Т1 – температура нагревателя, Т2 – температура холодильника.
Теорема Карно: КПД любого реального теплового двигателя не может превосходить КПД идеального теплового двигателя, работающего в том же температурном интервале.
Необратимость тепловых процессов означает, что тепловые процессы самопроизвольно протекают только в одном определенном направлении: тепло всегда передается от более горячего тела к более холодному; в обратном направлении они могут протекать только как одно из звеньев более сложного процесса.
Проблемы охраны окружающей среды, вызванные использованием тепловых двигателей: 1) постепенное повышение средней температуры на Земле из-за отвода части тепла в окружающую среду при производстве электрической и механической энергии; 2) повышение средней температуры на Земле из-за «парникового эффекта», возникающего при сжигании топлива в больших масштабах (выделенный при этом углекислый газ не пропускает в космос тепловой поток от Земли).
Свойства вещества
Испарение и конденсация. Насыщенный пар. Свойства насыщенного пара. Ненасыщенный пар. Влажность воздуха, точка росы. Приборы для определения влажности, принцип их действия. Кипение. Зависимость температуры кипения жидкости от внешнего давления
Парообразование – явление превращения жидкости в пар.
Два вида парообразования: испарение и кипение.
Испарение – парообразование, происходящее со свободной поверхности жидкости.
Скорость испарения жидкости зависит от: 1) рода жидкости; 2) ее температуры; 3) площади поверхности; 4) факторов, способствующих удалению молекул пара с поверхности жидкости (в частности, ветра).
Охлаждение жидкости при испарении, т.к. ее покидают наиболее быстрые молекулы, а остаются более медленные.
Кипение – процесс интенсивного парообразования, происходящий не только со свободной поверхности жидкости, но и по всему её объёму внутрь образующихся при этом пузырьков пара.
Жидкость закипает при условии, что давление её насыщенного пара в пузырьках становится равным сумме внешнего давления ро, гидростатического давления вышележащих слоёв жидкости ρgh и давления 2σ/R, связанного с кривизной поверхности пузырька (σ – коэффициент поверхностного натяжения жидкости, R – радиус пузырька).
Температура кипения жидкости зависит от: 1) давления насыщенного пара жидкости (чем оно выше, тем ниже температура кипения и наоборот); 2) внешнего давления (чем оно выше, тем выше температура кипения и наоборот).
Конденсация – явление превращения пара в жидкость.
Насыщенный пар –пар, находящийся в динамическом равновесии со своей жидкостью.
 Динамическое (подвижное) равновесие пара и жидкости –состояние, при котором число молекул, покидающих поверхность жидкости за некоторое время, равно числу молекул пара, возвратившихся за то же время в жидкость.
Динамическое (подвижное) равновесие пара и жидкости –состояние, при котором число молекул, покидающих поверхность жидкости за некоторое время, равно числу молекул пара, возвратившихся за то же время в жидкость.
Свойства насыщенного пара: 1) давление и плотность при неизменной температуре не зависят от объема, занимаемого паром; 2) давление зависит только от температуры; 3) зависимость давления от температуры описывается формулой 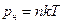 ; 4) состояние описывается уравнением состояния идеального газа.
; 4) состояние описывается уравнением состояния идеального газа.
Зависимость давления насыщенного пара от температуры носит нелинейный характер (рис. 19).
Участок ВС графика зависимости рн(T) соответствует состоянию, когда вся жидкость испарилась и в сосуде находится только пар, поведение которого подчиняется закону Шарля (изохорический процесс).
Объяснение нелинейного характера зависимости давления насыщенного пара от температуры: одновременное изменение температуры и концентрации молекул (плотности пара).
Ненасыщенный пар – пар, не находящийся в динамическом равновесии со своей жидкостью.
Ненасыщенный пар можно сделать насыщенным путем 1) сжатия при неизменной температуре, 2) охлаждения при неизменном давлении. 3) одновременного сжатия и охлаждения.
Абсолютная влажность воздуха – содержание водяного пара (в граммах) в 1 м3 воздуха при данных условиях, т.е. плотность водяного пара.
Относительная влажность воздуха – отношение абсолютной влажности воздуха к плотности насыщенного водяного пара при той же температуре.
Формулы для расчета относительной влажности воздуха:
1)  ,2)
,2) 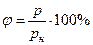 ,где
,где  и
и  – плотность и давление соответственно водяного пара в воздухе при данной температуре,
– плотность и давление соответственно водяного пара в воздухе при данной температуре,  и
и  – плотность и давление соответственно насыщенного водяного пара при данной температуре.
– плотность и давление соответственно насыщенного водяного пара при данной температуре.
Точка росы – температура, при которой ненасыщенный водяной пар, находящийся в воздухе, становится насыщенным.
Приборы для измерения влажности воздуха: 1) волосной гигрометр; 2) конденсационный гигрометр; 3) психрометр.
Принцип действия волосного гигрометра: изменение длины обезжиренного человеческого волоса при изменении влажности воздуха.
Принцип действия конденсационного гигрометра: 1) конденсация водяного пара, находящегося в воздухе на зеркальной металлической поверхности, охлажденной до точки росы; 2) фиксация точки росы термометром, встроенным в прибор; 3) определение по точке росы плотности (давления) водяного пара в воздухе при данных условиях (по таблице); 4) определение (по таблице) плотности (давления) насыщенного водяного пара по температуре воздуха в помещении (фиксируемой другим термометром); 5) определение относительной влажности воздуха путем деления плотности (давления) водяного пара (п. 3) на плотность (давление) насыщенного водяного пара (п. 4).
Принцип действия психрометра: 1) испарение воды с марли, которой обернут шарик влажного термометра; 2) охлаждение влажного термометра ниже температуры воздуха в помещении, фиксируемой сухим термометром; 3) фиксация разности показаний сухого и влажного термометров; 4) определение по разности показаний сухого и влажного термометров и показанию сухого термометра относительной влажности воздуха (по таблице).
Свойства поверхностного слоя жидкости. Поверхностное натяжение жидкостей. Силы поверхностного натяжения. Коэффициент поверхностного натяжения. Смачивание. Капилляры. Высота подъема (опускания) жидкости в капилляре. Капиллярные явления
Молекулы жидкости, находящиеся на ее поверхности, испытывают действие результирующей силы, направленной внутрь жидкости (более слабое взаимодействие этих молекул с молекулами пара, находящимися извне, нежели с молекулами, находящимися внутри жидкости).
Date: 2016-06-09; view: 1316; Нарушение авторских прав