
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Курсовая работа. по дисциплине «Основы технологии производства органических веществ»
|
|
по дисциплине «Основы технологии производства органических веществ»
на тему: «Технология получения винилхлорида из этилена сбалансированным по хлору способом»
Выполнил студент группы Х-21-08 Лукиянова Л.Л.
Проверил, доцент, к.х.н. Константинова Т.Г.
Работа защищена с оценкой
Чебоксары-2012
Оглавление
Введение……………………………………………………………….……3
1 Винилхлорид: применение, свойства, методы получения, используемое сырьё и отходы производства винилхлорида…………….……………..….4
1.1 Применение…………………………………………………….….…....4
1.2 Свойства…………………………………………………………..….…5
1.3 Получение………………………………………………………….…...7
1.3.1 Получение винилхлорида из ацетилена………………….…….....10
1.3.2 Комбинированный процесс получения
винилхлорида из ацетилена и этилена…………………………………..12
1.3.2. Метод окислительного хлорирования этана……………….…….14
2 Производство винилхлорида из этилена сбалансированным по хлору способом……………………………………...…………………………………..16
2.1 Теоретические основы процесса…………………………………..…16
2.2Технологическое оформление процесса получения винилхлорида сбалансированным по хлору методом……………………………………….....19
2.3 Принципы в технологии получения винилхлорида
сбалансированным по хлору методом……………………………….…..22
2.4Технология производства винилхлорида Vinnolit VCM Process..….27
3 Альтернативные методы производства винилхлорида……….…..…..29
Заключение……………………………………………………………..…30
Список использованной литературы……………………………………32
ВВЕДЕНИЕ
Целью курсовой работы является подробное изучения процесса производства винилхлорида из этилена сбалансированным по хлору способом.
При написании курсовой работы были поставлены следующие задачи:
- изучение и анализ наиболее эффективных методов получения винилхлорида;
- сбор и систематизация информации, достоинства и недостатки при разных методах получения хлористого винила;
- изучение влияния данного вещества на окружающую среду;
- обобщение и систематизация результатов исследования проблемы, содержащихся в научной литературе;
- наиболее полное изучение производства винилхлорида из этилена сбалансированным по хлору способом, рассмотрение теоретических основ процесса, технологическое оформление, принципы в технологии получения;
Потребность винилхлорида, как вещества, обуславливается созданием процессов которые учитывают как экономические, так и экологические аспекты. Выбор метода производства этого вещества является важной задачей.
1. Винилхлорид: применение, свойства, методы получения, используемое сырьё и отходы производства винилхлорида
1.1. Применение
Промышленное производство винилхлорида входит в первую десятку производства крупнейших многотонажных продуктов основного органического синтеза; при этом почти весь производимый объём используется для дальнейшего синтеза полихлорвинила (ПВХ), мономером которого и является винилхлорид. Из поливинилхлорида готовят листовые материалы и трубы (винипласт), пленки, заменители кожи, «перхлорвиниловую» смолу и т.д. Из сополимеров хлористого винила с винилиденхлоридом СН2=ССl2 и акрилонитрилом СН2=СНСN вырабатывают синтетические волокна (саран, виньон). Он служит также промежуточным продуктом для синтеза 1,1,2-трихлорэтана, винилиденхлорида, метилхлороформа[1]
Винилхлорид является одним из крупнейших по объему органических полупродуктов мирового химического производства, уступая лишь этилену (113 млн. тонн в 2008 году), пропилену (73 млн. тонн в 2008 году), этанолу (52 млн. тонн в 2008 году), бензолу (41 млн. тонн в 2008 году), метанолу (40 млн. тонн в 2008 году), терефталевой кислоте (39 млн. тонн в 2008 году). Производство винилхлорида является третьим после полиэтилена и окиси этилена по значимости направлением использования этилена как важнейшего химического сырья и составляет 11,9 % его мирового потребления (по данным на 2008 год). Мировое производство винилхлорида в 2008 году составило около 36,7 млн. тонн (99 % по отношению к 2007 году), что составляет 85 % всех мировых производственных мощностей (в 2007 году — 90 %). По прогнозным данным компании SRI Consulting, текущее сокращение потребления прекратится и в ближайшие пять лет (до 2013 года) будет наблюдаться рост потребления в размере 3,4 % в год и 2,5 % в последующие пять лет (с 2013 по 2018 гг.)
Крупнейшим потребителем винилхлорида в мире является Китай: около 30% всего мирового производства; на втором месте США и Канада, приблизительно с 20 % (по состоянию на 2008 год) Крупнейшим производителем винилхлорида в мире (по объёму производственных мощностей) являются США: 8,24 млн тонн по данным на 2003 год (для сравнения — в 1967 году мощности составляли 1,26 млн тонн, а в 1960 году всего 0,67 млн. тонн)
Вклад России в мировое производство винилхлорида довольно скромный: около 1,5 % от годового глобального выпуска и место во второй двадцатке стран-производителей (по состоянию на 2008 год). При этом технологическое оснащение серьёзно отстаёт от мирового: почти 30 % мощностей используют устаревшую ацетиленовую технологию.
Производство винилхлорида в России практически полностью (более 99 % всего объёма) ориентировано на выпуск поливинилхлорида, являясь при этом одним из крупнейших направлений потребления хлора в российской химической промышленности (18 % по данным на 2004 год).
В 2010—2013 годах компанией ООО «РусВинил» планируется ввод в эксплуатацию комплекса по производству ПВХ (включая и производство винилхлорида) в Кстовском районе Нижегородской области мощностью 330 тыс. тонн в год. Учредителями совместного предприятия являются компания «Сибур» и бельгийская компания SolVin — совместная дочерняя компания международной химико-фармацевтической группы Solvay и немецкого концерна BASF.
1.2. Свойства
Винилхлорид (хлористый винил, хлорэтен, монохлорэтилен) при нормальных условиях представляет собой бесцветный газ со слабым сладковатым запахом, напоминающим запах хлороформа. Порог ощущения запаха в воздухе составляет приблизительно 3000 частей на миллион. Малорастворим в воде (около 0,95% масс. при 15—85 °С), легко растворим в спирте, хлороформе и дихлорэтане, растворим в диэтиловом эфире. Винилхлорид обладает крайне высокой канцерогенной активностью.[2]
| Некоторые физические константы винилхлорида: | |
| температура кипения: −13,8 °C; температура плавления: −153,8 °C; относительная плотность при −20 °C: 0,983; относительная плотность при 20 °C: 0,911 плотность по воздуху: 2,17; критическая температура: 158,4 °C; критическое давление: 5,34 МПа; критическая плотность: 0,370 г/см³; вязкость жидкости при − 40 °C: 0,334 мПа·с; вязкость газа при 20 °C: 10,71 мкПа·с; |
По двойной связи винилхлорид вступает в реакции, типичные для олефинов; НС1 присоединяется к винилхлориду по правилу Марковникова, причем легче, чем к этилену, но с меньшей скоростью, чем к винилиденхлориду; реакция может протекать в жидкой фазе в присутствии А1С13 или FeCl3. В последнем случае возрастает селективность, но требуются повышенные температура (50-70°С) и давление. Продукт взаимодействия НС1О с винилхлоридом - хлорацетальдегид. Большое практическое значение имеет полимеризация винилхлорида и сополимеризация его с другими мономерами. Ингибиторы полимеризации - фенол или гидрохинон. Винилхлорид значительно менее активен при замещении атома хлора, чем этилхлорид. Однако хлор может быть замещен, например, при нагревании винилхлорида в спиртовом растворе алкоголята натрия под давлением, а также при взаимодействии винилхлорида с солями карбоновых кислот с образованием винилалкиловых эфиров, при конденсации с ароматическими или жирноароматическими соединениями Гриньяра в присутствии галогенидовметаллов типа СоС12 или СгС13. Окисляется винилхлорид до хлорацетальдегида или формальдегида, НС1 и СО, алкилируется, дегидрохлорируется в газовой фазе до ацетилена[3]
В окружающей среде винилхлорид появляется исключительно вследствие его выбросов во время производства и переработки. По оценке специалистов, более 99 % выброса винилхлорида остаётся в воздухе, где происходит его фотохимическая деградация под воздействием гидроксил- радикалов; при этом период его полураспада составляет 18 часов.
С поверхности почвы винилхлорид быстро испаряется, однако может мигрировать в её глубь через грунтовые воды. В растениях и животных не накапливается.
В почве и воде винилхлорид подвергается аэробной биодеградации (преимущественно до CO2) под воздействием микроорганизмов, например, рода Микобактерии биораспад в грунтовых водах может носить и анаэробный характер, причём его продуктами являются метан, этилен, углекислый газ и вода.
Исследования показывают, что в почве и воде под действием микроорганизмов винилхлорид разлагается на 30 % в течение 40 дней и на 99% в течение 108 дней
1.3. Получение
Первое время хлористый винил получали щелочным дегидрохлорированием 1,2-дихлорэтана в среде метилового или этилового спирта:
СlCH2-CH2Cl+ NaOH→CH2=CHCl+NaCl+H2O (1.3.1.)
Большой расход щелочи и хлора при этом синтезе ускорил разработку и внедрение в промышленность в 40-50-х годах гидрохлорирования ацетилена
CH≡CH+HCl→CH2-CHCl (1.3.2.)
Который связан с применением токсичных ртутных солей как катализаторов и сравнительно дорогостоящего ацетилена.
Осуществление термического дегидрохлорирования дихлорэтана позволило избежать расхода щелочи и использовать образующийся хлористый водород для гидрохлорирования ацетилена. Так появились комбинированные способы синтеза хлористого винила из ацетилена и этилена, сбалансированные по хлору.
На 2010 год существуют три основных способа получения винилхлорида, реализованные в промышленных масштабах. Винилхлорид можно получить различными способами:[4]
1. гидрохлорированием ацетилена в газовой или жидкой фазах в присутствии катализатора:
 (1.3.3.)
(1.3.3.)
2. дегидрохлорированием 1,2-дихлорэтана (в жидкой фазе) гидроксидом натрия в водной или спиртовой среде:
СН2С1 - СН2С1 + NaOH͢→ СН2 = CHCl + NaCl + Н20 (1.3.4.)
3. термическим дегидрохлорированием 1,2-дихлорэтана в паровой фазе в присутствии катализаторов, инициаторов или без них:
СН2C1 = CH2С1 → CH2=CHCl+HCl (1.3.5.)
4. хлорированием этилена в газовой фазе в объеме, либо в присутствии катализатора, например оксида алюминия:
CH2=CH2+Cl2→CH2=CHCl+HCl (1.3.6.)
Рассмотрим несколько наиболее распространенных промышленных способов производства винилхлорида из ацетилена и этилена.
Сырьем для получения винилхлорида являются этилен и хлор
Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином). При нормальных условиях — бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном. Этилен — самое производимое органическое соединение в мире; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год. Этилен обладает наркотическим действием.
Хлор- желто-зеленый газ с резким удушающим запахом; tпл. -100,98°С, tкип. -33,97 °С. Один из наиболее химически активных элементов, он непосредственно взаимодействует со всеми металлами и большинством неметаллов (образуя хлориды), лишь реакция хлора с О2, N2 требует специальных методов активации - УФ облучения или электроразряда, в остальных случаях достаточно простого нагревания. Практически весь производимый в мире хлор получают электрохимическим методом 
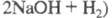 -электролизом водного раствора NaCl или, гораздо реже, КСl. Другие продукты электролиза - щелочь (1,13 т NaOH на 1 т С12) и Н2.
-электролизом водного раствора NaCl или, гораздо реже, КСl. Другие продукты электролиза - щелочь (1,13 т NaOH на 1 т С12) и Н2.
Date: 2016-02-19; view: 2180; Нарушение авторских прав