
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Разработка лекарства на базе соединений-лидеров
|
|
2.4.1. Поиск соединений – лидеров. Методы поиска.
Соединение-лидер - это химическое соединение, которое имеет желаемую, интересную, но не оптимальную активность. Это еще не лекарство, а в лучшем случае структурный прототип будущего лекарства (рис 1). На первом этапе задача создания лекарства как раз и сводится к тому, чтобы найти его прототип (если, конечно, он не был найден случайным образом). Второй этап – оптимизация тесно связан с первым, поэтому их можно рассматривать один единый процесс.
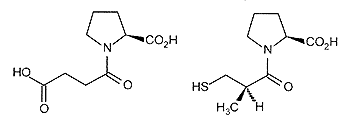 Рис. 5. N-сукцинилпролин — соединение-лидер при создании препарата каптоприла, понижающего кровяное давление
Рис. 5. N-сукцинилпролин — соединение-лидер при создании препарата каптоприла, понижающего кровяное давление
|
Критерии выбора соединений – кандидатов обсуждались нами в предыдущей части лекции (наличие нужной биологической активности, соответствие критериям биодоступности, отсутствие групп вызывающих токсичность). Безусловно, определяющим фактором является наличие нужной биоактивности, даже если активность вещества слабая и неселективная.
Для целенаправленного поиска соединения-лидера, нужно знать его биомишень, то есть макромолекулу в организме человека, на которую наше будущее лекарство должно воздействовать, связываясь с ней. В подавляющем большинстве случаев такой мишенью бывает белок (обычно рецептор или фермент), но это может быть и молекула ДНК, и другие важные биомолекулы. Стратегия поиска соединения-лидера зависит от того, что известно о его биомишенях, а также от того, что известно о структурах лигандов, которые с ней связываются (этот лиганд может, например, вырабатываться самим организмом (метаболит), быть лекарством или ядом). Здесь возможны три основных варианта:
1. Известна структура биомишени, но мы ничего не известно о ее возможных лигандах;
2. Известна структура лиганда – биологически активного соединения или метаболита, но ничего не известно о структуре его биомишени;
3. Известна структура и мишени и ее лиганда.
Если ничего не известно - ни структура биомишени, ни структура лиганда, то поиск соединения-лидера можно проводить только “вслепую”, тестируя то или иное реально существующее соединение на различные виды активности (скрининг комбинаторных библиотек).
Используемые сейчас методы компьютерного моделирования лекарств ( Computer-Aided Drug Design, CADD) направлены на ускорение и оптимизацию поиска новых биологически активных соединений. Их цель - генерация гипотез о возможных новых лигандах и их взаимодействии с мишенью. Однако эти подходы ни в коей мере не могут заменить экспериментального тестирования. Поэтому, каждый этап CADD должен заканчиваться экспериментальным. тестированием отобранных соединений. Если предсказанные базовые соединения не проявляют искомую активность, проводится повторный этап компьютерного моделирования, при этом принимаются во внимание полученные отрицательные результаты (например, для поиска используется другая база низкомолекулярных веществ, перестраивается фармакофорная или QSAR модели, выполняется дополнительный анализ структуры активного центра соединения с оценкой возможных конформационных изменений его структуры при связывании ли-гандов, учитывается участие в связывании молекул воды и т.д.). Если базовое соединение найдено, то проводится по циклам оптимизация его структуры для повышения биологической активности.
На этапе оптимизации синтезируются близкие по структуре соединения с последующим тестированием на биологическую (фармакологическую) активность. Когда требуемая активность оптимизированной структуры базового соединения будет достигнута, найденное соединение может быть передано на последующие доклинические испытания (испытания активности in vivo, на токсичность, канцерогенность и т.д.). По результатам этих тестов возможен повторный цикл компьютерного моделирования для оптимизации структуры с целью улучшения фармакокинетических свойств (адсорбционные, в процессах метаболизма, экскреции и т.п. — оптимизация ADME свойств). Считается, что CADD может уменьшить количество соединений, которые необходимо синтезировать и проверить на биологическую активность при разработке лекарственного препарата, примерно в 100 раз. Это позволяет резко сократить время и финансовые затраты на создание лекарств.
Как было указано выше, ключевым моментом в выборе метода CADD является наличие информации о пространственной структуре мишени. Если пространственная структура белка-мишени известна, то применяется группа методов конструирования лекарств на основе структуры мишени (Structure-Based Drug Design, SBDD), часто называемые прямыми методами. По этим методам можно сконструировать или найти соединения, которые комплементарны целевому участку на поверхности белка-мишени с учетом структурных и физико-химических свойств поверхности. При отсутствии информации о трехмерной структуре мишени используется другая группа методов — конструирование лекарств на основе структур лигандов (Ligand-Based Drug Design, LBDD), так называемые непрямые методы. В этом случае выполняется анализ известных лигандов к белку для выявления общих свойств лигандов, которые коррелируют с биологической активностью, и на основании полученных данных строится модель активного центра белка-мишени.
Еще более, ситуация упрощается, если заранее известна и структура биомишени, и воздействующего на неё лиганда. Исследователь фактически модифицирует в полости мишени структуру лиганда. Такой способ называется структурно-обоснованным дизайном.
Date: 2016-02-19; view: 721; Нарушение авторских прав