
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ароматические соединения пиранового ряда
|
|
Ароматические соединения пиранового ряда – пираны – шестичленные кислородные гетероциклы с ароматической структурой.
Пираны – структурные фрагменты многих природных соединений, обладающих биологической активностью, например флавоноидов
Флавоноиды представляют собой фенольные соединения, содержащие 15 атомов углерода. Девять из этих атомов чаще всего входят в состав остатка оксикоричной кислоты, который конденсируется с флороглюцином; таким образом фенилпропановый остаток С9 в растительных фенолах является преобладающим. Основные типы флавоноидов таковы:
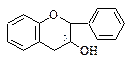 1. Катехины
1. Катехины
| 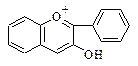 2. Антоцианидины
2. Антоцианидины
| 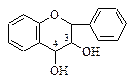 3. Лейкоантоцианидины (флавандиолы-3,4) 3. Лейкоантоцианидины (флавандиолы-3,4)
|
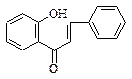 4. Халконы
4. Халконы
| 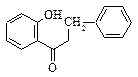 5. Дигидрохалконы
5. Дигидрохалконы
| 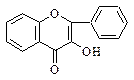 6. Флавонолы-3 6. Флавонолы-3
|
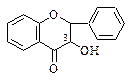 7. Флаванонолы-3 (дигидрофлавонолы-3)
7. Флаванонолы-3 (дигидрофлавонолы-3)
| 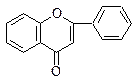 8. Флавоны
8. Флавоны
| 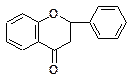 9. Флавононы (дигидрофлавоны) 9. Флавононы (дигидрофлавоны)
|
Структурную основу всех природных флавоноидов (биофлавоноидов) составляет трициклическая молекула 2-фенилбензо-γ-пирона (или 2-фенилхромона), называемая флавоном. Таким образом, основная флавоноидная структура состоит из двух бензольных колец, обозначаемых А и В, соединенных С3-фрагментом, который вместе с кислородным атомом образует γ-пироновое кольцо – С6 – С3 – С6.
Связующий С3-фрагмент, который образует гетероциклическое кольцо, определяет класс, к которому принадлежит тот или иной флавоноид. Этот фрагмент может быть представлен несколькими состояниями, которые имеют различную степень окисления. Каждое из этих состояний соответствует отдельному классу флавоноидов, как это показано на схеме Приложения А.
In vivo флавоноиды обычно существуют в виде гликозидов. Свободные флавоноиды называются агликонами.
Число индивидуальных флавоноидных агликонов велико; оно включает около 300 флавонов и флавонолов, 50 халконов, 20 антоцианидинов. Число же их возможных гликозидов и ацилированных гликозидов поистине огромно.
Среди названий флавоноидов преобладают тривиальные, обычно являющиеся производными от названия того растения, из которого данное соединение было впервые выделено или в котором оно обычно содержится, например дельфинидин был выделен из дельфиниума. Это приводит к затруднениям и недоразумениям, поскольку даже очень близкородственные соединения, например разные гликозиды одного и того же агликона, могут иметь совершенно несходные наименования. Как выражение крайнего случая иногда для одного и того же соединения используют два совершенно различных названия.
Химические свойства флавоноидов уже давно интенсивно исследовались методами классической органической химии. С их помощью было разработано несколько главных путей синтеза флавоноидов. Флавоноиды обычно вступают в реакции, характерные для их замещающих групп, например гидроксильных. Связующий С3-фрагмент гетероциклического кольца может подвергаться восстановлению или окислению; при этом возможны ограниченные превращения флавоноидов одного класса в флавоноиды другого. Щелочное расщепление, часто требующее жестких условий, приводит к разрыву флавоноидной молекулы на два фрагмента, содержащие бензольные кольца. Эта
реакция может оказаться полезной для установления распределения заместителей в кольце, правда, подобную информацию сейчас
обычно получают спектроскопическими методами (УФ- и ЯМР-спектроскопией, масс-спектрометрией).
Природные флавоноидные гликозиды сравнительно хорошо растворимы в воде и, как правило, могут быть выделены из растительных объектов экстракцией водой или водно-спиртовыми растворами. Антоцианы несут положительный заряд, и их экстракция требует умеренно кислых условий. Обычно флавоноиды более стабильны в отношении света, умеренного нагревания и изменений рН, чем большинство других пигментов: флавоноиды некоторых классов весьма неустойчивы к действию солнечного света, а также в условиях щелочных значений рН. Это относится прежде всего к катехинам, проантоцианидинам, флаван-3,4-диолам, а также к антоцианидинам и их гликозидам антоцианам.
Важное место среди флавоноидных соединений занимают катехины, в отличие от других классов флавоноидов, как правило, не образующие гликозидов. Наряду с лейкоантоцианами катехины являются родоначальниками дубильных веществ конденсированного ряда. Это наиболее восстановленные соединения, легко окисляются при нагревании и при освещении солнечными лучами. Особенно быстро их окисление протекает в щелочной среде и при действии окислительных ферментов (полифенолоксидаза, пероксидаза). Обладают наиболее высокой Р-витаминной активностью по сравнению с другими флавоноидами. Очищенные препараты катехинов получают из чайных листьев и применяют в медицине. М.Н. Запрометов установил, что наибольшим капилляроукрепляющим действием обладают препараты неокисленных катехинов, а потому полифенолы зеленого чая в несколько раз эффективнее, чем катехины черного чая. От большинства других веществ, обладающих Р-витаминной активностью, катехины чая выгодно отличаются хорошей растворимостью в воде, что облегчает их усвоение.
Из различных природных источников выделены следующие катехины: катехин (Acacia catechu), галлокатехин и робенетинидол (Acacia molissima), галлокатехин (дельфинидол) также выделен из листьев чая, эпиафзелехин выделен из сердцевинной части древесины видов Afzelia, афзехенин – из Eucalyptus calophylla.
Антоцианы – гликозиды антоцианидинов и производные одной и той же ароматической структуры – флавиниевого катиона. Этот катион состоит из бензопирилиевого ядра (А) и фенольного кольца (Б). Оксониевая структура антоцианов установлена в 1913 г., а антоцианидинов – в 1914. Было предложено агликоны называть антоцианидинами, а гликозиды – антоцианами. Термин «антоциан» впервые введен Маркартом в 1835 г. и происходит от греческих слов anthos, что означает «цветок» и cyanos – «синий».
Антоцианы – важнейшие пигменты цветов, плодов и т.д., придающие им синюю или красную окраску с разными сочетаниями и переходами. Антоцианы – окрашенные гликозиды. Их агликонами являются антоцианидины. Антоцианы растворимы в воде, антоцианидины – нерастворимы. Благодаря свободному положительному заряду в кислом растворе антоцианидины ведут себя как катионы и образуют соли с кислотами, в щелочном – как анионы и образуют соли с основаниями. В зависимости от рН среды изменяется окраска антоцианов. Соли катионов антоцианов окрашены в красный цвет разных оттенков. Щелочные соли антоцианов окрашены в синий цвет.
Различают шесть главных антоцианидинов: пеларгонин, цианидин, дельфинидин, мальвидин, пеонидин и петунидин. Реже встречается апигенин. Пигменты многих плодов и цветов представляют собой смесь различных антоцианов. Например, в чернике содержатся моногликозиды сирингидина и дельфинидина. В таблице 5 приводятся сведения о распространенных антоцианах.
Таблица 5 – Характеристика наиболее распространенных антоцианов
| Антоциан | Антоцианидин (агликон) | Углевод | Распространение |
| Пеларгонин | Пеларгонидин | Две глюкозы | Пеларгония, астры, далия |
| Пеонин | Пеонидин | Две глюкозы | Пион |
| Цианин | Цианидин | Две глюкозы | Роза, василек, далия |
| Керацианин | Цианидин | Рамноза, глюкоза | Вишня |
| Пруницианин | Цианидин | Рамноза, глюкоза | Слива |
| Дельфин | Дельфинидин | Рамноза, глюкоза | Шпорник |
| Вигланин | Дельфинидин | Рамноза, глюкоза | Мать-и-мачеха |
| Энин | Мальвидин | Глюкоза | Виноград |
| Геснерин | Апигенин | Глюкоза | Гесснерия |
Как видно из таблицы 5, наиболее часто встречающиеся углеводы – глюкоза и рамноза, обнаружены галактоза и генциобиоза, в немногих случаях найдена также ксилоза.
Пеларгонидин был выделен впервые Вильштеттером и Болтоном из цветков герани (Pelargonium zonale). Производные пеларгонидина встречаются в астрах, георгинах, шалфее.
Цианидин – 4-оксипеларгонидин встречается в фиолетово-красной расе цветов василька, а его производные – в цветах розы, некоторых видов астр, плодах брусники, терновника, мака и т.д.
Дельфинидин выделен из цветов рогатых васильков (Delphinium consolida) и найден в фиалках (Viola tricolor).
Структурное разнообразие антоцианов базируется, прежде всего, на вариациях вида, количества, структуры и места прикрепления сахаров и других заместителей.
Как и все флавоноиды антоцианы обладают Р-витаминной активностью, а также сильным бактерицидным действием.
Применение антоцианов в качестве красящих добавок к пище ограничено использованием экстрактов из сильно пигментированных плодов, таких как черный виноград и черника. Эти экстракты представляют собой многокомпонентные смеси, включающие различные водорастворимые вещества. Чистые препараты антоцианов пока не используются в качестве пищевых красителей, поскольку при значениях рН выше 4 их окраска нестабильна.
Лейкоантоцианидинами называют соединения, близкие к катехинам. Лейкоантоцианидины широко распространены в растениях в основном в мономерной форме. Они бесцветны, но при нагревании с минеральными кислотами превращаются в антоцианидины и приобретают характерную окраску. Лейкоантоцианидины были впервые изучены русским ученым М.С. Цветом в 1914 году, который показал их широкое распространение. Он выделил после их обработки соляной кислотой соответствующие антоцианидины и описал свойства полученных соединений, назвав их проантоцианидинами. Хотя лейкоантоцианидины не являются лейкоформами антоцианов, название исторически закрепилось за всей группой веществ.
Лейкоантоцианидин – бесцветен при н/у, при температуре около 125 ºС – желтый, при 165 ºС – винно-красный, выше 225 ºС – сине-серый, при 260 ºС – черный. Как и катехины, все мономерные лейкоантоцианы хорошо растворимы в воде, спирте, ацетоне, этилацетате, не растворимы в бензине, хлороформе. Отличительная особенность лейкоантоцианов – их чрезмерная склонность к полимеризации. В плодах мономерные лейкоантоцианидины всегда сопровождаются олигомерами и полимерами, в которых лейкоантоцианидиновые единицы связаны в повторяющиеся звенья, способные деполимеризоваться при горячем кислотном гидролизе с получением антоцианидинов. Способность к полимеризации способствует высокой окисляемости и затрудняет их выделение и идентификацию.
Лейкоантоцианидины являются, как и катехины и антоцианидины, производными хромана.
Халконы – желтые природные пигменты. Большинство халконов – вещества, окрашенные в различные оттенки желтого цвета. Нередко они входят в состав хромофорных комплексов, обуславливающих окраску цветов, как, например, часто встречающийся в семействе сложноцветных халкон бутеин. Окисление халконов способствует углублению окраски. Так, хинон картамон, пигмент цветов сафлора, представляет собой вещество ярко-красного цвета. Многие халконы обладают фунгицидным и бактерицидным действием. Биосинтез
некоторых из них «запускается» в ответ на заражение растений пато-
генными микроорганизмами, т.е. определенные халконы выполня-
ют защитную функцию (пиностробин сосны и др.). Будучи α- и β-ненасыщенными кетонами, халконы являются весьма реакционноспособными веществами и вступают в многочисленные вторичные реакции, основными из которых являются димеризация, гликолизирование и восстановление.
Халконы можно рассматривать как флавоноиды с раскрытым пирановым кольцом. Соединения халконового типа переходят во флавононы путем простого замыкания колец. Многие из представителей этой группы встречаются в растениях в виде гликозидов. Так, например, бутеин в виде 4-гликозида кореопсина найден в Coreopsis giganiea, халконарингенин – в виде 2-гликозида изосалипурпозида в Salix purpyrea. Характерной особенностью халконов является их легкая изомеризация в соответствующие флавононы при обработке минеральными кислотами.
В кислой среде халконы превращаются в флавононы: например, халкон бутеин превращается в флавонон бутин. Оба эти вещества содержатся в цветах азиатского дерева Butea frondosa. К природным халконам относятся ланцеолин из видов Coreopsis, салипурпозид из ивы пурпурной, флоретин и др. Флоретин – агликон гликозида флоредзина, ингибитора прорастания семян.
Дигидрохалконы являются относительно мало изученной группой флаваноидов. В растениях присутствуют исключительно в виде гликозидов. Наиболее известным представителем дигидрохалконов является флоридзин (флоретин-2/-глюкозид), найденный в различных видах Malus, где он содержится в коре корней (до 12 % на сухой вес), листьях, молодых побегах и семенах. Флоридзин обнаружен также в Kalmia latifolia и различных видах Pieris. У человека он вызывает интенсивное выведение глюкозы из организма, так называемый «флоридзиновый диабет».
В некоторых видах Malus, наряду с флоридзином, присутствует сиболдин (3-оксифлоретин-4/-гликозид). Азебогенин в виде 2/-гликозида азеботина найден в Kalmia angustifolia и различных видах Pieris [4].
Флавонолы наряду с флавонами принадлежат к желтым красящим веществам растений, издавна применявшихся для крашения тканей. Это наиболее многочисленная группа флавоноидных соединений. Известно около 70 агликонов, самыми распространенными из которых являются:
– кемпферол (из листьев вереска, ягод крушины и т.д.);
– кверцетин содержится в виде гликозида кверцитрина (или кверцитин-рамнозида) в коре красильного дуба (Quercus tinctoria) и в целом ряде других растений (виноград, хмель, чай, ясень, молочай, фиалка и т.д.); рутин (3-рутинозид кверцетина) – наиболее известный гликозид кверцетина, выделенный впервые из руты (Ruta graveolens) и найденный затем в большом числе других растений. Рутин применяется в медицине в качестве капилляроукрепляющего средства, хотя по своей активности уступает катехинам; в виде других гликозидов и в свободном виде встречается в хмеле, чае, цветах красной розы и желтой мать-и-мачехи). Метиловый эфир кверцетина – рамнетин – содержится в виде гликозида в ягодах крушины.
Восстановление пиранового ядра флавонолов приводит к флавононам (аналогично восстановлению халконов в дегидрохалконы).
Флавоны являются желтыми красящими веществами растений. Известно более 40 агликонов флавоновой природы – лютеолин, апигенин, трицин, хризин, динатин и др. Встречаются в растениях
в виде агликонов, но наиболее часто в виде гликозидов двух рядов:
О-гликозиды и С-гликозиды. Образование последних является характерной особенностью флавонов. С-гликозиды обладают большой устойчивостью к кислотному гидролизу и не атакуются гидролитическими ферментами.
Путем восстановления можно перейти от флавонолов к производным бензопирилия – антоцианам. Соли пирилия уже вполне устойчивые соединения, широко распространенные в природных объектах.
Флаваноны по сравнению с другими флавоноидами встречаются довольно редко, известно около 30 представителей этой группы флавоноидов. Они найдены в семействах Rosaceae, Rutaceae, Leguminosae, Compositae. Особенно характерны для плодов семейства Citrus. Так, гесперитин в виде гликозида геспередина содержится в альбедо и мякоти апельсина, лимона, цитрона; гликозид нарингина нарингенин является основным флавоноидом грейпфрута; гликозид эриодиктола эриоцитрин содержится в лимоне и т.д. Установлено, что на горький вкус флавононовых гликозидов влияет углеводная составляющая, так как агликоны – гесперетин и нарингенин – безвкусные или даже слегка сладкие вещества. Рутинозид гесперетина также безвкусен, тогда как его другой гликозид неогеспередин, равно как и нарингин и понцирин, являются горькими веществами, близкими к горечи хинина.
Характерной особенностью флавононов является легкость их изомеризации в соответствующие халконы: нарингенин → халконирингенин. Щелочные условия благоприятствуют образованию халконов, кислые – приводят к накоплению флавононов.
Флаваннонолы-3 отличаются от флаванонов наличием ОН-группы при С3 (дигидрофлавонолы-3). Они также лабильны и поэтому не накапливаются в растениях в значительных количествах. Чаще встречаются в свободном состоянии, чем в форме гликозидов. По строению и свойствам близки к лейкоантоцианидинам, которые являются флавандиолами. Типичным примером флаванонола может служить таксифолин.
Большинство флаванонолов было выделено из древесины хвойных (сосна, лиственница, кедр) или лиственных (эвкалипт, бук, вишня) пород, где они находятся частично в виде агликонов, а частично в виде 3-гликозидов или 3-рамнозидов. 7-гликозиды и 4/-гликозиды флаванонолов встречаются значительно реже. Они найдены в лепестках цветков примулы и петунии.
При нагревании водных растворов флаванонолов они легко переходят в соответствующие флавонолы. При восстановлении дают флаванонов. Являются возможными предшественниками многих других групп флавоноидных соединений.
Для флавоноидов характерны тенденции к расширению своих биологических возможностей, что, очевидно, связано с увеличением количества и разнообразия функциональных групп и с изменением их гидрофильно-липофильных характеристик. Последний фактор особенно существенно влияет на проявление их антиоксидантных свойств, в конечном счете, открывая различные протекторные возможности таких веществ. А т.к. токсичность и катехинов, и кумаринов, и флавоноидов, как правило, очень низка, то и поиск лекарственных субстанций на основе их химической модификации может быть перспективным.
Изофлавоноиды встречаются довольно редко и представлены следующими четырьмя группами соединений:
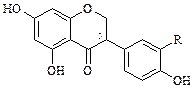 Изофлаваноны
Изофлаваноны
| 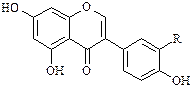 Изофлавоны
Изофлавоны
|
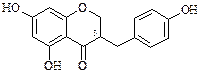 Дигидрогомоизофлаваноны
Дигидрогомоизофлаваноны
| 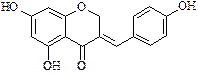 Гомоизофлаваноны.
Гомоизофлаваноны.
|
В настоящее время определено строение более чем 25 природных соединений. Источником изофлавоноидов являются растения семейства Leguminosae). К ним относят гинестеин из бобов сои (Soja hispida), текторигенин (Iris tectorum), иригенин (Iris florentina) из корней фиалки, формононетин (Cicer arietinum), прунетин (Prunus avium) и др.
Кумарины распространены в растительном мире практически повсеместно. Эти соединения являются производными лактона цис -ортооксикоричной кислоты и наиболее простой и четкой является их классификация по числу и характеру циклов, сконденсированных с кумариновым ядром. Кумарины – соединения, у которых ядро кумарина не сконденсировано с ароматическим, гетероароматическим или насыщенным циклом. Как правило, в положениях 3…8 соединений находятся окси-, алкокси- и алкильные группы:
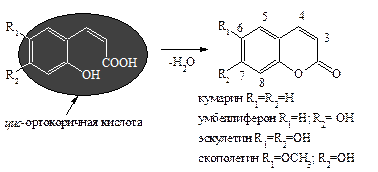
Кумарины – летучие компоненты многих растений, имеют запах свежескошенного сена: умбеллиферон встречается в растениях семейства сельдерейных (Apiaceae), эскулетин содержится в околоплодниках конского каштана в виде гликозида эскулина и т.д.
Фурокумарины – соединения, у которых кумариновое ядро сконденсировано с фурановым циклом. В зависимости от места конденсации фуранового цикла и его расположения по отношению к основному ядру различают: линейные 2',3': 6,7-фурокумарины (производные псоралена) и ангулярные – производные 2',3: 7,8-фурокумарина, изопсоралена:
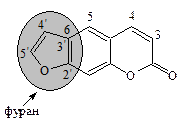 2',3': 6,7-Фурокумарин
(псорален)
2',3': 6,7-Фурокумарин
(псорален)
| 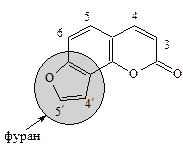 2',3': 7,8-Фурокумарин
(изопсорален, ангелицин)
2',3': 7,8-Фурокумарин
(изопсорален, ангелицин)
|
В гликозидированных формах кумарины и фурокумарины представлены в черемухе (2…5 мг/100 г), чернике (1,3…3,6 мг/100 г), морошке (2,0…4,4 мг/100 г). В плодах облепихи и ягодах черники содержатся также оксикумарины (75…90 мг/100 г), проявляющие антикоагуляционное действие и предупреждающие образование тромбов.
Для антраценпроизводных (гиперицин и псевдогиперицин зверобоя) и фурокумаринов характерно фотосенсибилизирующее действие, предположительно это обусловлено их непосредственным включением в биохимический механизм образования пигмента меланина. Фотодинамическая активность этих соединений проявляется в том, что, будучи относительно инертными в темноте, эти соединения приобретают биологическую активность при ультрафиолетовом облучении.
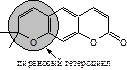
Пиранокумарины – соединения, в которых кумариновое ядро сконденсировано с 2,2-диметилпирановым циклом. Как и у фурокумаринов, различаются линейные соединения по 6,7-положениям (производные ксантилетина) и ангулярные, у которых 2,2-диметилпирановый цикл сконденсирован с кумариновым в 5,6- (производные сезелина) или 7,8-положениях (производные келлантона):
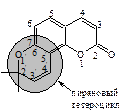
| 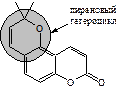
| 
|
| 2',2'-Диметилпирано- 5',6': 7,8-кумарин | 2',2'-Диметилпирано- 5',6': 5,6-кумарин | 2',2'-Диметилпирано- 5',6': 6,7-кумарин |
Кумэстаны содержат систему бензофурана, сконденсированную в 3,4-положениях с кумарином:
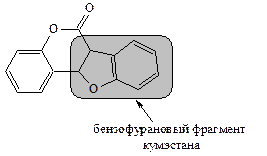
Димер кумарина, образующийся при нарушении условий хранения кумаринсодержащего растительного сырья, является антикоагулянтом, поэтому использование испорченного сырья травы донника или корневищ дягиля (как основных источников кумаринов), цветков ромашки, травы пустырника и горца птичьего, листьев и почек березы и некоторых других кумаринсодержащих видов сырья в производстве алкогольных напитков может привести к тяжелым физиологическим последствиям.
Хиноны
Хиноны – класс соединений, тесно связанный с фенолами, так как они легко образуются при окислении последних (особенно двух- и трехатомных) и, в свою очередь, легко восстанавливаются до фенолов.
Хиноны представляют собой большую и довольно гетерогенную группу соединений. Их окраска варьируется от бледно-желтой через оранжевую, красную, пурпурную и коричневую до почти черной. Они являются важными пигментами у ряда грибов, лишайников, некоторых групп беспозвоночных животных и высших растений, в последних, как правило, содержатся в тканях, которые обычно не видны (в коре, ядровой древесине и корнях). Они редко вносят заметный вклад в наружную окраску высших растений. Некоторые хиноны, однако, являлись основой важнейших красителей еще в античные времена, например, хны и марены. Некоторые хиноны – менихинон, пластохинон, филлохинон и убихинон, – представляют собой важные биологические молекулы.
Хиноны могут происходить от различных ароматических углеводородов и соответственно получать свои названия и от исходного углеводорода: так, производные бензола называются бензохинонами, нафталина – нафтохинонами.
Почти все хиноны представляют собой твердые вещества и легко кристаллизуются. Большинство из них хорошо растворимы в органических растворителях.
Классифицируют хиноны по двум структурным признакам: по ароматическому углеводороду, к которому они привязаны углеродным скелетом (бензохиноны, нафтохиноны и антрахиноны) и по взаимному положению карбонильных групп в молекуле (орто -бензохиноны, пара -бензохиноны, 1,4-нафтохиноны и т.д.). При этом орто -хиноны встречаются значительно реже, чем пара -хиноны.
Наиболее широко распространенными и имеющими наибольшее значение как пигменты являются нафтохиноны и антрохиноны.
Из производных природного бензохинона, в первую очередь, следует отметить – убихинон и пластохинон, производные которых представляют собой целую группу соединений с разнообразной биологической активностью: антипаразитарной, противовоспалительной, антиВИЧ и др.
Производные бензохинона часто участвуют в окраске грибов, например, красный пигмент мухомора мускаруфин, пигмент гриба Paxillus adromentosus атроментин и др. В целом же бензохиноны не являются сильно окрашенными соединениями и не вносят ощутимого вклада в природную окраску растений и организмов.
Нафтохиноны часто встречаются в растениях в связанной форме, т.е. в виде гликозидов, если они содержат еще и фенольную функцию.
К природным нафтохинонам относят витамины К, филлохинон и менахинон – широко распространенные и важные в биологическом отношении молекулы. Нафтохиноны обнаружены в различных тканях высших растений – в листьях, цветках, плодах, корнях, коре и древе-сине.
Наиболее интересными представителями нафтохинонов являются: юглон, лаусон и их производные, полученные из зеленых частей грецкого ореха (Juglans redia); менахиноны относятся к группе жирорастворимых витаминов группы К (например, антигеморрогический витамин К1 филлохинон. Генетически с группой витаминов К связаны витамины группы Е (витамины размножения), широко распространенные в растительном мире, из которых биологически наиболее активен α-токоферол; тизанон – из грибов Thysanophora penicilloides, обнаруживает активность против HRV 3С-протеазы из семейства вирусов, ответственных за заболевания полиомиелитом и гепатитом; парахол – из корней дерева Tectona grandis, из растения Tabebiua avellanedae, является иммуномодулятором, цитотоксичен; молиссин – желтый пигмент из культур Molissa fallens; алканнин – краситель из Alcanna tinctorica.
Во многих растениях, относящихся к семействам мареновых (Rubiceae), гречишных (Polygonaceae), бобовых (Leguminosae), лилейных (Liliáceae), зверобойных (Hypericaceae), крушиновых (Rhamnaceae) встречаются антрахиноновые производные, которые обычно находятся в них в форме гликозидов. В растениях, грибах и лишайниках найдено почти 200 представителей этой группы.
Вещества такой структуры обладают двумя практически полезными свойствами: они способны возбуждать перистальтику толстого кишечника, что используется в медицине – эмодин, получаемый из ревеня (Rhamnus franguia) обладает выраженным слабительным эффектом, франгулин (крушина); второе свойство гидроксилированных антрахинонов связано со способностью образовывать прочные, ярко окрашенные комплексы хелатного типа с катионами металлов, откуда и происходит группа ализариновых красителей – ализарин является протравным красителем, получаемым из корней марены красильной (Rubia tinctorium). Известны и другие пигменты, производные антрахинона: алканин, выделенный из разных представителей семейства бурачниковых (Alkanna, Anchusa, Echium, Onosma, Macrotomia и др.), санталин, птерокарпин (красное дерево).
В античные времена некоторые хиноновые пигменты ценились как красители. Растения, служившие источниками этих пигментов, часто выращивали на больших полях и плантациях для снабжения сырьем красильщиков. Вероятно, наиболее широко распространенной из античных красок была марена, получаемая из измельченных корней Rubia tinctorum, которую применяли древние персы, египтяне, греки и римляне. Красящим веществом марены является смесь антрахинонов, среди которых преобладает ализарин, служащий основой стабильных красных красок. Хотя ализарин сейчас практически вышел из употребления как краситель, он все еще находит применение при изучении роста костей.
Хна – желто-коричневый препарат из листьев Lawsonia alba в течение долгого времени использовалась в Африке и на Востоке для окрашивания и в косметических целях. Следы хны до сих пор обнаруживают на ногтях египетских мумий. Красящим веществом ее является нафтохинон лавсон, который легко экстрагируется из листьев L. alba водным раствором карбоната натрия.
В качестве примеров можно привести также экстракты, содержащие нафтохинон алканин и его эпимер шиконин, которые использовались римлянами и древними японцами, и корни моринды, применявшиеся в Индии, на Яве и в Новой Зеландии, красящим веществом которых являются антрахиноны, подобные мориндону.
Наконец, необходимо упомянуть о хиноновых красителях, приготовляемых из насекомых. Вероятно, наиболее известным античным красителем этого типа является кармин, который получали из огромного числа червецов Kermococcus ilicis. Его красящую основу составляет антрахинон кермезиновая кислота. Сходное соединение, карминовая кислота, из другого насекомого – Dactylopius coccus – является активным началом кошенили, впервые использованной, вероятно, инками вПеру и до сих пор в небольших количествах применяющейся для окрашивания пищевых продуктов, а также гистологических препаратов.
С развитием современной синтетической химии крупномасштабное производство и использование природных хиноновых красителей сильно сократилось; лишь некоторые из них используются
до сих пор в качестве красителей для пищевых продуктов, вин и косметики.
Еще в древнейшие времена препараты хинонов применяли в медицине в качестве слабительных. Нафтохиноны и антрахиноны ответственны за послабляющее действие александрийского листа, крушины и ревеня. В последнее время у некоторых природных хинонов обнаружена противовирусная, антибактериальная и фунгицидная активность, причем число таких хинонов растет. В некоторых случаях их можно использовать как антибиотики при лечении инфекционных
заболеваний. Так, стрептоварицины, представляющие собой оран-жевые макролидные нафтохиноны, проявляют заметную активность
in vivo против Mycobacterium tuberculosis.
В различных природных источниках весьма нередко встречаются соединения хиноидной природы, структуры которых не всегда однозначно можно отнести к тому или иному классическому типу: псоротамнон А, получаемый из кустарника Psorothamnus junceas, обладает определенной противоопухолевой активностью; блефаризмины являются фоточувствительными красителями из организмов Blepharisma japonicum – при освещении УФ и видимым светом (in vivo и in vitro) меняют окраску в диапазоне красный-голубой (λmax = 576…592 нм). Эти соединения выделяются также высокой биологической активностью, связанной с их высокой реакционной способностью их карбонильных групп.
Список литературы к разделу 6
1. Скорикова, Ю.Г. Полифенолы плодов и ягод и формирование цвета продуктов / Ю.Г. Скорикова. – М.: Пищевая промышленность, 1973. – 232 с.
2. Племенков, В.В. Введение в химию природных соединений / В.В. Племенков. – Казань: 2001. – 376 с.
3. Семенов, А.А. Очерк химии природных соединений / А.А. Семенов. – Новосибирск: Наука. Сибирская издательская фирма РАН, 2000. – 664 с.
4. Блажей, А. Фенольные соединения растительного происхождения: пер. со словацкого / А. Блажей, Л. Шутый. – М.: Мир, 1977. – 239 с.
5. Тутельян, В.А. Биологически активные вещества растительного происхождения. Фенольные кислоты: распространенность, пищевые источники, биодоступность / В.А. Тутельян, Н.В. Лашнева // Вопросы питания. – 2008. – Т. 77. – № 1. – С. 4–19.
6. Татарченко, И.И. Химия субтропических и пищевкусовых продуктов / И.И. Татарченко, И.Г. Мохначев, Г.И Касьянов. – М.: Издательский центр «Академия», 2003. – 256 с.
7. Благовещенский, А.В. Биохимия растений / А.В. Благо-вещенский. – М.-Л.: ОНТИ Государственное химико-техническое изд-во, 1934. – 459 с.
8. Гребинский, С.О. Биохимия растений / С.О. Гребинский. – Львов: Изд-во Львовского ун-та, 1967. – 271 с.
9. Шретер, В. Химия / В. Шретер [и др.]; пер. с нем. – 2-е изд., стереотип. – М.: Химия, 2000. – 648 с.
10. Грандберг, И.И. Органическая химия / И.И. Грандберг. –
4-е изд., перераб. и доп. – М.: Дрофа, 2001. – 672 с.: ил. С. 355–356.
11. Марх, А.Т. Биохимия консервирования плодов и овощей / А.Т. Марх. – М.: Пищевая промышленность, 1973. – 371 с.
12. Бриттон, Г. Биохимия природных пигментов / Г. Бриттон; пер. с англ. – М.: Мир, 1986. – 423 с.
13. Танчев, С.С. Антоцианы в плодах и овощах / С.С. Танчев. – М.: Пищевая промышленность, 1980. – 304 с.
Date: 2015-05-23; view: 1799; Нарушение авторских прав