
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Количественные характеристики ионитов
|
|
Полная обменная емкость (ПОЕ) ионита – количество молей эквивалентов ионогенных групп (активных центров) в 1 кг сухого ионита (или молей эквивалентов в ионите с насыпным объемом 1м3).
Статическая обменная емкость (СОЕ) ионита – количество молей эквивалентов ионогенных групп в расчете на 1 кг сухого ионита (или молей эквивалентов в ионите с насыпным объемом 1м3), обменявших свои ионы на ионы из раствора в условиях ионообменного равновесия между ионитом и раствором электролита с данной концентрацией С ионов и данной температурой Т. Понятно, что СОЕ < ПОЕ.
Схема эксперимента для определения СОЕ изображена на рис. 3.
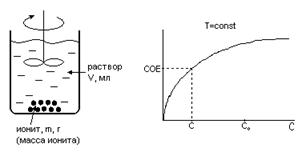
Рис.3. Слева - схема опыта по определению статической емкости ионита. Справа – изображение результатов опытов в виде графика изотермы ионного обмена.
Время t к контакта раствора с ионитом до установления ионообменного равновесия составляет до 60 часов! Расчет СОЕ проводят, используя уравнение баланса ионов в растворе и в твердой фазе ионита
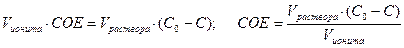 ,
,
где V ионита – насыпной объем ионита, находящегося в контакте с раствором, м3 (тогда СОЕ должна иметь размерность моль эквивалентов/м3);
V – объем раствора, м3;
С о – исходная концентрация обменивающихся с ионитом ионов, моль эквивалентов/м3;
С – концентрация ионов, оставшаяся в растворе к моменту достижения равновесия между раствором и ионитом.
Динамическая обменная емкость (ДОЕ) ионита. Ее определяют экспериментально путем пропускания раствора с постоянной скоростью через колонку (ионообменный аппарат) со слоем ионита.
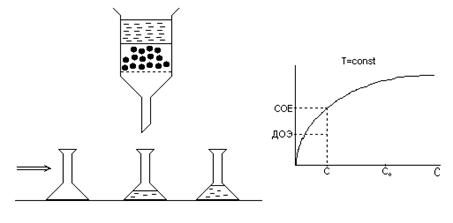
Рис.4. Схема опыта (слева) для определения статической обменной емкости слоя зерен ионита. Справа на графике изотермы показано, как соотносятся величины СОЕ и ДОЕ.
После колонки фильтрат собирают по фракциям для их анализа с целью определения момента появления проскока. В этом случае время контакта недостаточно для установления ионообменного равновесия и, следовательно, ДОЕ < СОЕ. Время контакта t к равно времени, за которое через колонку проходит объем раствора, равный насыпному объему V и ионита, загруженного в аппарат (колонку)
t к = V и / L,
где L – объемный расход очищаемого раствора, м3/с.
Ясно, что при увеличении объемного расхода очищаемой воды через ионообменный аппарат (при увеличении производительности аппарата) время t к контакта раствора с ионитом уменьшается, и, следовате6льно, уменьшается ДОЕ, т.е. уменьшается доля используемой статической обменной емкости ионита.
Ниже в табл. 1 и 2 приведены количественные характеристики некоторых используемых в промышленности ионитов.
Таблица 1. Характеристики основных марок отечественных катионитов, используемых при водоподготовке.
| Марка катио-нита | Основа матрицы (химический состав матрицы) | Функциональные группы, привитые к матрице | Кислотность (способность к диссоциации функциональной группы) | ПОЭ (молей экв.)/м3 | Насып-ная плотность, т/м3 | Размер зерна, мм |
| КУ-2 | Полистирол | -SO3H | Сильнокислотн. | 0.8 | 0.3-1.5 | |
| КУ-1 | Фенолформальдегид | -SO3H | То же | 0.7 | 0.3-2.0 | |
| КФ-1 | Полистирол | -PO(OH)2 | Среднекислотн. | 0.7 | ||
| КБ-1 | Метакриловая к. | -COOH | Слабокислотный | 0.6 | 0.3-1.5 |
Таблица 2. Характеристики основных марок отечественных анионитов, используемых при водоподготовке.
| Марка катионита | Основа матрицы | Функциональная группа | Кислотность | ПОЭ (молей экв)/м3 | Насыпная плотность, т/м3 | Размер зерна, мм |
| АВ-17×8 | Полистирол | R3N+ | Сильноосновный | 0.7 | 0.4-1.2 | |
| АВ-16 | Эпокси- полиамин | RNH, R2N, R3N+ | Промежуточный | 0.8 | 0.3-1.8 | |
| АН-22 | Полистирол | NH2, RNH | Слабоосновный | 0.7 | 0.2-1.0 |
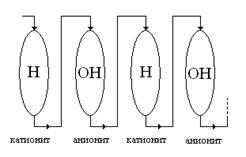
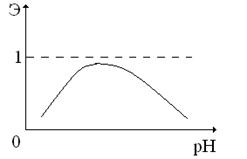
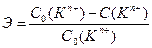
Рис. 5. Слева изображена повсеместно используемая схема последовательного включения в цепь колонок с катионитом в Н-форме и анионитом в ОН-форме в многоступенчатых установках для обессоливания воды. Справа с помощью графика показано, как изменяется эффективность задержки катионов слабых (слабых, не сильных!) оснований из раствора в зависимости от рН раствора.
Вопрос. Известно (рис.5), что эффективность Э задержки катионов слабых оснований при фильтрации раствора через катионит в Н-форме при увеличении рН сначала увеличивается, а затем уменьшается. Почему?
Ответ. При малых рН в растворе много ионов 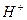 и они мешают обмену других катионов (см. пояснения к уравнениям реакций ионного обмена (7) и (8)). А при больших рН в растворе преобладают ионы
и они мешают обмену других катионов (см. пояснения к уравнениям реакций ионного обмена (7) и (8)). А при больших рН в растворе преобладают ионы 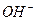 и начинается связывание катионов слабых оснований с образованием взвеси слаборастворимых гидроксидов, которые тоже не вступают в ионный обмен (хотя могут частично задерживаться в слое зёрен, но теперь уже как взвесь).
и начинается связывание катионов слабых оснований с образованием взвеси слаборастворимых гидроксидов, которые тоже не вступают в ионный обмен (хотя могут частично задерживаться в слое зёрен, но теперь уже как взвесь).
Если вернуться к разобранному выше примеру (рис.2 на стр.5), то следует добавить, что в лучших условиях (с большей эффективностью) подвергаются ионному обмену катионы 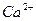 (они не конкурируют с
(они не конкурируют с 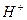 ионами). В более худших условиях находятся ионы
ионами). В более худших условиях находятся ионы 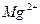 (концентрация ионов
(концентрация ионов 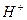 в воде в зоне осаждения
в воде в зоне осаждения 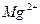 увеличивается). В ещё более плохих условиях обмениваются ионы
увеличивается). В ещё более плохих условиях обмениваются ионы 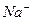 (концентрация ионов
(концентрация ионов 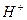 в воде в зоне осаждения
в воде в зоне осаждения 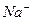 становится ещё большей). Отсюда следует, что лучше очищать воду ступенчато, используя многократное повторение рассмотренной на стр.5 схемы.
становится ещё большей). Отсюда следует, что лучше очищать воду ступенчато, используя многократное повторение рассмотренной на стр.5 схемы.
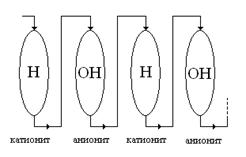
Рис. 6. Схема обессоливания воды в многоступенчатой установке переменного действия методом ионного обмена (на рисунке изображены две ступени).
При этом при постоянных суммарных объёмах катионита и анионита эффективность очистки будет увеличиваться с увеличением n количества ступеней. Наилучший результат получится при n 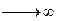 , что конструктивно реализуется в ионообменном аппарате смешанного действия.
, что конструктивно реализуется в ионообменном аппарате смешанного действия.
Date: 2015-05-23; view: 2277; Нарушение авторских прав