
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Наследственные нарушения обмена аминокислот
Фенилкетонурия. Термин фенилкетонурия (ФКУ) был введён Пенроузом и Квостелем в 1937 году для обозначения этого заболевания и используется до настоящего времени.
Фенилкетонурия (ФКУ) является наиболее распространенной аминоацидопатией. Частота ФКУ среди новорожденных по данным массового скрининга в различных странах составляет в среднем 1:10000, однако значительно варьирует в зависимости от популяции: от 1:4560 в Ирландии, до 1:100000 в Японии. По Mc Kusick выделяется несколько типов фенилкетонурии:
Фенилкетонурия I типа (классическая ФКУ);
Фенилкетонурия II типа (атипичная ФКУ);
Фенилкетонурия III типа.
Фенилкетонурия I типа.
Фенилкетонурию I типа (классическая форма) впервые описал в 1934 году норвежский биохимик и психиатр А. Феллинг. Лишь спустя 19 лет другой исследователь Джервис (1953) после проведённой серии экспериментов пришёл к раскрытию биохимической основы этого заболевания – блокирование реакции гидроксилирования L-фенилаланина и превращения его в L-тирозин вследствие дефицита фермента фенилаланин - 4 – гидроксилазы (КФ 1.14.16.1)*, который гидроксилирует фенилаланин с образованием тирозина (рис. 4.).
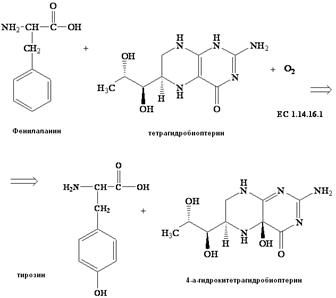
Рис.4.Реакция катализируемая ферментом фенилаланилгидроксилазой (КФ 1.14.16.1), превращение L-фенилаланина в L-тирозин. Кофактором фермента является тетрагидробиоптерин и ионы Fe2+.
*Рецессивная мутация гена, расположенного в 12-ой хромосоме, кодирующего фенилаланингидроксилазу, наследуется по аутосомно-рецессивному типу, оба пола поражаются с одинаковой частотой. Заболевание проявляется только у гомозигот.
В связи с тяжестью клинических проявлений и возможностью профилактического лечения ФКУ рекомендована ранняя диагностика этого заболевания среди новорожденных. В настоящее время проба с хлорным железом - FeCl3 (проба Феллинга) используется в виде бумажных тест полосок для обнаружения с первых дней жизни в моче больных детей деривиата фенилаланина (фенилпировиноградной кислоты).
В настоящее время установлено, что фенилгидроксилирующая система у человека представляет собой сложный комплекс, состоящий из нескольких ферментов и коферментов:
1) фенилаланингидроксилаза (КФ 1.14.16.1), локализована в цитозоле клеток, высокая активность в клетках печени, эпидермальных тканях (меланоциты);
2) дигидроптеридинредуктаза (КФ 1.5.1.34);
3) дигидрофолатредуктаза (КФ 1.5.1.3);
4) кофактор: тетрагидроптеридин.
В результате блокирования основного катаболического пути превращения фенилаланина при ФКУ, происходит накопление фенилаланина и продуктов его дезаминирования и окислительного декарбоксилирования (фенилпирувата, фениллактата, фенилацетата) в крови. Высокие уровни фенилаланина в крови при ФКУ в раннем детстве приводит к нарушению процессов миелинизации в ЦНС, что является одним из биохимических факторов приводящих к нарушению умственного развития детей (олигофрении). Метаболиты фенилаланина – фенилпируват, фениллактат обладают токсическим действием на ЦНС.
Ребенок с фенилкетонурией выглядит при рождении здоровым. Отставание в психическом развитии может происходить постепенно и стать очевидным через несколько месяцев. Установлено, что нелеченный ребенок теряет около 50 баллов IQ к концу первого года жизни. Отставание психического развития обычно довольно выражено, и большинство детей нуждаются в социальной помощи. Об актуальности данного заболевания, свидетельствует проблема материнской ФКУ, лишь недавно появившаяся в России. Наблюдается высокая частота умственной отсталости среди потомства женщин, страдающих ФКУ и не получающих диету в зрелом возрасте.
У многих пациентов с фенилкетонурией светлые волосы и голубые глаза, что связано с недостаточностью синтеза меланина из тирозина, образование которого при фенилкетонурии блокировано.
Фенилкетонурия II типа
Впервые атипичная ФКУ была описана Smith I. в 1974 году, а Kaufman S.и др. в 1975 году обнаружили дефицит дигидроптеридинредуктазы при этом состоянии. Заболевание наследуется по аутосомно-рецессивному типу. Генный дефект локализуется в коротком плече 4 хромосомы, участке 4р15.3. В результате недостаточности дигидроптеридинредуктазы (КФ 1.5.1.34) нарушается восстановление активной формы тетрагидробиоптерина, участвующего в качестве кофактора в гидроксилировании фенилаланина, тирозина и триптофана. Вследствие этого развиваются метаболические блоки на путях превращения фенилаланина в тирозин, а также образования предшественников нейромедиаторов катехоламинового и серотонинового ряда L-ДОФы и 5-окситриптофана, что подтверждается резким снижением содержания в тканях и жидкостях больного организма (в том числе в мозге и цереброспинальной жидкости) их конечных продуктов - гомованилиновой и 5-оксиндолуксусной кислот.
Фенилкетонурия III типа
Этот вариант болезни впервые описан Kaufman S. и др. в 1978 году. Заболевание наследуется по аутосомно-рецессивному типу и связано с недостаточностью 6-пирувоилтетрагидроптеринсинтазы, участвующей в процессе синтеза тетрагидробиоптерина из дигидронеоптеринтрифосфата. Ключевую роль в патогенезе играет дефицит тетрагидробиоптерина. Развивающиеся при этом расстройства сходны с нарушениями, наблюдаемыми при ФКУ II.
Диагноз ФКУ устанавливается при обнаружении у новорождённого ребёнка высоких концентраций фенилаланина в крови на 6-10 день после рождения и при положительном результате скринигового теста на фенилпировиноградную кислоту. Во многих странах мира все новорождённые обследуются на ФКУ.
Алкаптонурия. Наследственное заболевание, связанное с расстройством обмена аминокислоты тирозина и экскрецией с мочой большого количества (до 4-8 г/сутки) гомогентизиновой кислоты (2,5-дигидрофенилуксусной кислоты). Дефицит (недостаточность) оксидазы гомогентизиновой кислоты (КФ 1.13.11.5)*, (рис. 5.) приводит к тому, что гомогентизиновая кислота не переходит в другой метаболит – малеилацетоацетат (рис. 6.) и выводится с мочой. Вследствие окисления гомогентизиновой кислоты кислородом воздуха образуются окрашенные пигменты, придающие тёмный цвет мочи больных алкаптонурией.
Рис. 5. Кристаллическая структура человеческой оксидазы гомогентизиновой кислоты (КФ 1.13. 11.5). Фермент является гексамером, содержащим атомы Fe2+
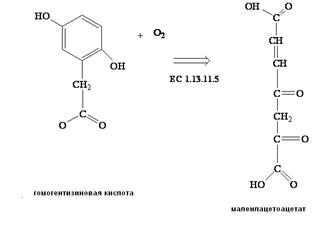
Рис.6. Реакция, катализируемая ферментом оксидазой гомогентизиновой кислоты (КФ 1.13.11.5) превращение гомогентизиновой кислоты в 4 – малеилацетоацетат. Кофактором фермента являются ионы Fe2+.
Впервые это заболевание описал Scribonius в 1584 году. В 1859 году Boedeker H. назвал алкаптоном вещество, содержащееся в моче и обуславливающее потемнение мочи при соприкосновении с кислородом воздухом в результате окисления гомогентизиновой кислоты.
Алкаптонурия распознается сразу после рождения из-за характерного окрашивания пелёнок ребёнка в черный цвет. Кроме этого у этих больных описано повреждение хрящевой ткани с развитием артритов. Алкаптонурия распространена в Доминиканской республике, Чехословакии, Германии, США, Индии.
*Ген оксидазы гомогентизиновой кислоты человека (HGD) локализован на длинном плече 3 хромосомы. У больных алкаптонурией в гене HGD выявлены нуклеотидные замены (missense мутации), сплайсинговые, интронные мутации, инсерции и делеции. Наследуется по аутосомно-рецессивному типу. Частота заболевания по данным разных авторов колеблется от 1:1000000 до 1:10000000.
Альбинизм. Группа генетических заболеваний, характеризующихся дефицитом или полным отсутствием синтеза пигмента меланина. Обусловлено это заболевание отсутствием каталитической активности фермента тирозиназы (КФ 1.14.18.1), катализирующей три реакции в цепи биосинтеза меланина:
1) гидроксилирование L-тирозина в 3,4-диоксифенилаланин (ДОФА);
2) окисление ДОФА в ДОФА-хинон;
3) окисление 5,6-диоксииндола в индол-5,6-хинон.
В основе данного заболевания вследствие нарушения биосинтеза меланина лежит врождённое отсутствие пигмента в коже и ее придатках, радужной и пигментной оболочках глаза. Полный альбинизм известен среди всех рас и народов. Несколько чаще альбинизм встречается среди североамериканских негров, индейцев народности Цуни (штат Аризона, США), индейцев Мексики, обитателей Сицилии.
Date: 2015-05-23; view: 1185; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |