
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Специфические пути обмена отдельных аминокислот
|
|
Эти пути обмена определяются различиями в строении радикалов аминокислот, поэтому они разнообразны и многочисленны. Вступая в эти специфические реакции, аминокислоты принимают участие во многих важных процессах:
а) в синтезе гормонов и нейромедиаторов,
б) в синтезе простетических групп сложных белков - хромопротеинов и нуклеопротеинов,
в) в синтезе сложных липидов,
г) синтезе веществ, содержащих макроэргическую связь и являющихся источником энергии для клеток,
д) в обезвреживании токсических веществ.
Вступая в эти процессы, аминокислоты участвуют в них как всей своей молекулой, так и своими отдельными фрагментами (или группировками). Ими являются аминогруппа (NH2) и одноуглеродные фрагменты: -СН3, -CH2-, -С=О, -СН=, -СН2ОН.
Одноуглеродные фрагменты образуются из простейших аминокислот - глицина, серина, аланина и треонина под действием ферментов, коферментом которых является тетрагидрофолиевая кислота/ТГФК/. ТГФК - производное витамина Вс (фолиевой кислоты), она образуется из фолиевой кислоты в результате ее восстановления с помощью НАДФН2. Одноуглеродный фрагмент, соединенный с ТГФК называют активным одноуглеродным фрагментом или " активный С1.
ОБМЕН ГЛИЦИНА И СЕРИНА.
Это заменимые аинокислоты, которые превращаются друг в друга.
Основным путем распада глицина является его распад на СО2, Н2О и метилен-ТГФК (активный С1):
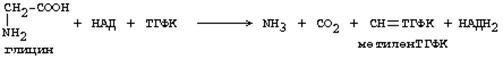
Из метилен-ТГФК могут образовываться все другие формы активного С1: формил-ТГФК, метил-ТГФК, метен-ТГФК, оксиметил-ТГФК в результате реакций окисления или восстановления метилен-ТГФК.
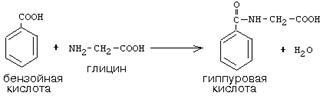
Активный С1, образовавшийся из глицина участвует в синтезе пуриновых азотистых оснований. Кроме того, глицин всей своей молекулой участвует в синтезе гема гемоглобина и других гемопротеинов, в синтезе пуриновых азотистых оснований, в синтезе парных желчных кислот (гликохолевая кислота), в синтезе креатина, в синтезе трипептида глютатиона. Также глицин в печени участвует в обезвреживании бензойной кислоты, которая превращается в гиппуровую кислоту:
Основным путем распада серина является его превращение в метилен-ТГФК и глицин:
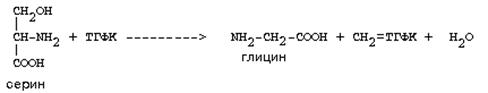
Всей своей молекулой серин участвует в синтезе сложных липидов - фосфолипидов. Он участвует в синтезе фосфатидилсерина, который декарбоксилируется и превращается в фосфатидилэтаноламин, который после метилирования превращается в фосфатидилхолин. В реакции метилирования участвует активная форма метионина - S-аденозилметионин.
Серин в составе белков-ферментов участвует в формировании каталитического центра фермента, например, в сериновых протеазах: трипсине, химотрипсине и др. Также серин участвует в формировании гидратной оболочки белков, потому что является полярной аминокислотой.
ОБМЕН СЕРУСОДЕРЖАЩИХ АМИНОКИСЛОТ: МЕТИОНИНА И ЦИСТЕИНА.
Метионин - это незаменимая аминокислота, а цистеин - заменимая.
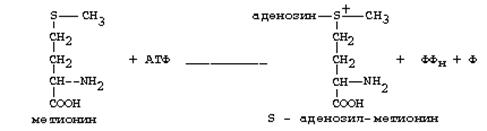
Главной особенностью обмена метионина является то, что из него тоже образуется активный С1 в виде СН3-группы, которая участвует в различных синтезах. Однако, этот активный С1 образуется без участия ТГФК. Чтобы стать источником СН3- группы, метионин подвергается активации с участием АТФ. В результате этой реакции от АТФ отщепляются все три остатка фосфорной кислоты, а аденозин присоединяется к атому серы метионина. Так образуется активная форма метионина - S- аденозил-метионин.
S-аденозил-метионин участвует в реакциях трансметилирования. Наиболее важный из них синтез фосфатидилхолина из фосфатидилэтаноламина, обезвреживание биогенных аминов с участием О-метилтрансфераз, синтез адреналина из норадреналина, синтез ацетилхолина из холина и Ацетил-КоА, синтез креатина, который в виде креатинфосфата является резервной формой макроэргических связей и участвует в обеспечении нервной ткани и работающей мышцы АТФ.
Синтез креатина.

В синтезе креатина участвуют и другие аминокислоты - аргинин и глицин. В почках из аргинина и глицина образуется гуанидинацетат, который метилируется в печени с участием S-аденозил-метионина и в результате образуется креатин:
Гомоцистеин участвует в синтезе амикислот - цистеина (гомоцистеин + серин). Креатин подвергается фосфорилированию с участием АТФ, в результате образуется соединение с макроэргической связью - креатинфосфат. Это обратимая реакция, которая катализируется ферментом креатинфосфокиназой (КФК).

Эта реакция интенсивно идет в мышцах, особенно, в сердечной мышце, и в ткани мозга. Креатинфосфат активно синтезируется в покое и распадается при мышечной работе. Это наиболее быстрый способ регенерации АТФ. Креатин, образовавшийся из креатинфосфата распадается до креатинина, который является конечным продуктом и выводится с мочой. В сутки выводится 1-2 грамма креатинина. Это количество креатинина прямо пропорционально мышечной массе, поэтому у мужчин креатинина в моче больше, чем у женщин. Креатинин не реабсорбируется из первичной мочи, поэтому его количество во вторичной моче характеризует объем клубочковой фильтрации.

При поражении мышечных клеток и нарушении ткани мозга креатинфосфокиназа появляется в крови, это является диагностическим признаком. Известно, что КФК имеет три изофермента - кардиальный, церебральный и мышечный, появление их в крови позволяет определить поражение соответствующего органа. Появление в крови кардиального изофермента является ранним диагностическим признаком инфаркта миокарда.
ОБМЕН ЦИСТЕИНА.
Это заменимая аминокислота, она синтезируется из серина, гидроксильная группа которого замещается SН-группой, которую поставляет гомоцистеин. Цистеин в составе белков-ферментов своей -SН группой участвует в образовании каталитического центра (тиоловые протеазы), а также участвует в образовании дисульфидных связей, которые принимают участие в формировании третичной и четвертичной структуры белков. Также цистеин необходим для синтеза трипептида глютатиона, который состоит из цистеина и глютаминовой кислоты. Молекула глутатиона условно обозначается как (Г-SН). Глютатион способен легко окисляться и восстанавливаться:
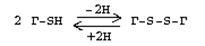
Окисляясь, глютатион предохраняет от окисления другие вещества, например, двухвалентное железо гемоглобина в эритроцитах:

Восстанавливается глютатион с помощью НАДФН2 с участием фермента глютатионредуктазы.

Цистеин подвергается и распаду, при этом он окисляется и декарбоксилируется, в результате образуется таурин, который участвует в образовании парных желчных кислот (таурохолевая и др.) в печени.
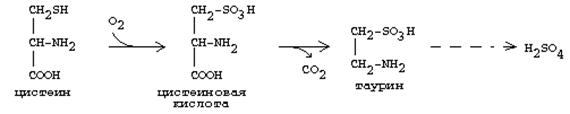
Серная кислота, которая образуется из таурина, участвует в обезвреживании токсических веществ в печени.

Так обезвреживаются продукты гниения белков в кишечнике - индол, скатол, фенол и крезол. В этих процессах серная кислота участвует в своей активной форме в виде 3’-фосфоаденозин-5’-фосфосульфата (ФАФC), которая образуется с участием АТФ.
ОБМЕН АРГИНИНА
Аргинин - частично незаменимая аминокислота. Она образуется в ходе синтеза мочевины в печени из карбомоилфосфата при участии аспарагиновой кислоты и орнитина. Аргинин участвует в синтезе креатина в почках, являясь донором гуанидиновой группы в образовании гуанидинацетата. В составе белков аргинин как полярная положительно заряженная аминокислота участвует в образовании ионных связей и в формировании гидратной оболочки белков.
ОБМЕН ДИКАРБОНОВЫХ АМИНОКИСЛОТ - ГЛУТАМИНОВОЙ И АСПАРАГИНОВОЙ
Эти аминокислоты вступают в многочисленные химические реакции, с которыми Вы уже знакомы и поэтому они играют главную роль в обмене аминокислот.
1. Они участвуют в реакциях синтеза заменимых аминокислот и следовательно в коррекции аминокислотного состава белков, а, значит, в коррекции аминокислотного состава клеток организма.
2. Участвуют в реакциях обезвреживания аммиака и других токсичных продуктов азотистого обмена.
3. Превращаясь в альфа-кетокислоты (альфакетоглутарат и ЩУК), они принимают участие во взаимосвязи обмена белков с обменом углеводов и жиров.
4. Дикарбоновые аминокислоты и их амиды (глутамин и аспарагин) участвуют в реакциях синтеза почти всех азотсодержащих соединений клеток (нуклеотидов, нуклеиновых кислот, аминосахаров и аминопроизводных липидов). В этих реакциях синтеза они являются донором азота в виде NН2-группы, или участвуют всей своей молекулой.
КОНКРЕТНАЯ РОЛЬ КАЖДОЙ АМИНОКИСЛОТЫ:
Глутаминовая кислота
а) подвергается прямому окислительному дезаминированиюс образованием альфа-кетоглутарата,
б) вступает в реакции трансаминирования, которые катализируют специфические трансаминазы,
в) является субстратом для синтеза глютамина, который является транспортной формой аммиака и участвует в синтезе мочевины в печени, также глютамин участвует в синтезе пуриновых оснований нуклеотидов и нуклеиновых кислот, аминосахаров и аминопроизводных липидов.
г) принимает участие в косвенном дезаминировании АК-т,
д) участвует в синтезе трипептида глютатиона,
е) является субстратом для образования гамма- аминомасляной кислоты.
Аспарагиновая кислота
а) участвует в реакциях трансаминирования,
б) в синтезе мочевины, как донор NН2-группы,
в) в синтезе пиримидиновых оснований (всей молекулой) и как донор NН2-группы - в синтезе пуриновых оснований,
г) в синтезе аспарагина.
Обе аминокислоты участвуют в формировании третичной и четвертичной структур белков, так как являются полярными заряженными аминокислотами и в образовании гидратной оболочки белков, а также эти аминокислоты принимают участие в формировании активных центров ферментов. Амидирование аспарагиновой и глутаминовой кислот приводит к образованию глутамина и аспарагина, необходимых для синтеза белков.
ОБМЕН ЦИКЛИЧЕСКИХ АМИНОКИСЛОТ ФЕНИЛАЛАНИНА И ТИРОЗИНА
Фенилаланин является незаменимой аминокислотой, а тирозин - заменимая аминокислота.
Фенилаланин вступает в незначительное количество превращений в тканях. Кроме включения этой аминокислоты в структуру молекул белка, единственным путем метаболизма фенилаланина у здорового человека является его окисление в тирозин с участием фермента микросомального окисления, специфической монооксигеназой - фенилаланингидроксилазой:

Тирозин вступает в многочисленные реакции в различных тканях. В результате этих превращений тирозин не только распадается до конечных продуктов, но и дает промежуточные метаболиты, из которых образуются ряд важных соединений, некоторые из которых являются биологически активными веществами.
Из тирозина образуются:
а) гормоны мозгового слоя надпочечников адреналин и норадреналин,
б) меланины - пигменты кожи, волос, радужной оболочки глаза,
в) йодсодержащие гормоны щитовидной железы - тироксин и трийодтиронин.

НАРУШЕНИЯ ОБМЕНА ФЕНИЛАЛАНИНА И ТИРОЗИНА
Нарушения обмена этих АК связано с нарушением биосинтеза некоторых ферментов, которые катализируют метаболические превращения этих АК. Результатом нарушения синтеза ферментов является возникновение наследственных генетических заболеваний:
1) фенилкетонурия - нарушен синтез фенилаланин-гидроксилазы, поэтому фенилаланин превращается в фенилпируват, который оказывает токсическое воздействие на развитие некоторых отделов головного мозга.
2) альбинизм - нарушен синтез ферментов, превращающих ДОФА в ДОФА-хром, поэтому нарушается синтез меланинов.
3) алкаптонурия - нарушен синтез диоксигеназы гомогентизиновой кислоты, она выделяется с мочой, моча приобретает черный цвет.
4) кретинизм - нарушен синтез йодиназы, что приводит к нарушению синтеза йодсодержащих гормонов щитовидной железы.
5) может быть нарушен синтез фермента тирозиназы, который катализирует превращение тирозина в ДОФА, следовательно будет нарушаться синтез гормонов мозгового слоя надпочечников и меланина.
Из всех этих заболеваний в настоящее время удается лечить фенилкетонурию, для этого из рациона ребенка исключают фенилаланин и увеличивают в пище количество тирозина. Если ребенка держать на этой диете до 6-7 лет, тогда не возникает умственная отсталость, т.к. к 6-7 годам успевают развиться отделы головного мозга, развитие которых задерживается при избытке в ткани мозга фенилпирувата.
Date: 2015-05-23; view: 1568; Нарушение авторских прав